Definisi Titrasi Asam Basa
Titrasi asam basa adalah salah satu teknik analisis kimia yang digunakan untuk menentukan konsentrasi suatu larutan asam atau basa. Secara sederhana, titrasi asam basa dapat dijelaskan sebagai proses penambahan larutan standar basa ke dalam larutan asam atau sebaliknya hingga tercapai titik ekuivalen.
Titik ekuivalen dicapai ketika jumlah larutan basa yang ditambahkan sudah cukup untuk mereaksikan semua asam dalam larutan sampel atau sebaliknya. Teknik ini dapat digunakan dalam berbagai bidang, seperti industri farmasi, pangan, dan kimia, serta digunakan dalam penelitian dan pengembangan produk baru.
Dengan memahami definisi dan prinsip dasar titrasi asam basa, kita dapat memahami bagaimana teknik ini digunakan dalam analisis kimia dan dapat memaksimalkan potensinya dalam berbagai bidang.
Tujuan Titrasi Asam Basa
Tujuan utama dari titrasi asam basa adalah untuk menentukan konsentrasi suatu larutan asam atau basa. Dalam proses titrasi, kita menggunakan larutan standar yang diketahui konsentrasinya untuk mereaksikan dengan larutan sampel yang konsentrasinya tidak diketahui. Dengan menentukan titik ekuivalen, yaitu titik di mana jumlah basa yang ditambahkan sudah cukup untuk mereaksikan semua asam dalam sampel, kita dapat menghitung konsentrasi asam atau basa dalam larutan sampel.
Selain itu, teknik ini juga dapat digunakan untuk menentukan pH suatu larutan atau mencari konstanta asam atau basa dari senyawa. Dalam berbagai bidang seperti industri farmasi, pangan, dan kimia, penggunaan titrasi asam basa sangat penting untuk menjamin kualitas produk dan memastikan bahwa konsentrasi asam atau basa dalam suatu larutan terjaga. Dengan memahami tujuan dari titrasi asam basa, kita dapat menggunakan teknik ini dengan tepat dan efektif dalam analisis kimia serta meningkatkan kualitas produk yang dihasilkan.
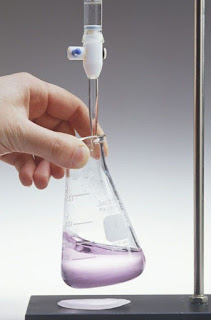
Peralatan yang diperlukan
Untuk melakukan titrasi asam basa, ada beberapa peralatan dasar yang diperlukan, seperti labu ukur, buret, dan erlenmeyer. Labu ukur digunakan untuk mengukur volume larutan sampel dan larutan standar yang akan digunakan dalam titrasi. Buret digunakan untuk menambahkan larutan standar ke dalam larutan sampel secara perlahan, sehingga titik ekuivalen dapat tercapai dengan lebih akurat. Erlenmeyer digunakan sebagai wadah untuk larutan sampel dan juga sebagai tempat untuk menambahkan larutan standar.
Selain itu, diperlukan juga indikator titrasi yang berguna untuk membantu menentukan titik ekuivalen. Indikator yang paling umum digunakan adalah fenolftalein, yang akan berubah warna dari bening menjadi merah muda ketika titik ekuivalen sudah tercapai.
Di samping peralatan dasar tersebut, juga diperlukan alat pengukur pH seperti pH meter atau kertas lakmus untuk mengetahui pH larutan selama titrasi. Pemilihan peralatan yang tepat dan akurat sangat penting dalam melakukan titrasi asam basa agar hasil yang diperoleh akurat dan terpercaya.
Jenis-jenis Indikator Titrasi
Indikator titrasi adalah zat yang digunakan untuk membantu menentukan titik ekuivalen dalam titrasi asam basa. Ada beberapa jenis indikator yang dapat digunakan, seperti fenolftalein, metil jingga, bromtimol biru, dan fenol merah.
Fenolftalein, indikator paling umum yang digunakan dalam titrasi asam basa, memiliki rentang pH 8,2 hingga 10,0. Ketika titik ekuivalen dicapai, fenolftalein akan berubah warna dari bening menjadi merah muda. Metil jingga, indikator yang digunakan pada rentang pH 3,1 hingga 4,4, akan berubah warna dari merah menjadi kuning ketika titik ekuivalen tercapai. Bromtimol biru, indikator yang digunakan pada rentang pH 6,0 hingga 7,6, akan berubah warna dari kuning menjadi biru ketika titik ekuivalen tercapai. Fenol merah, indikator yang digunakan pada rentang pH 6,8 hingga 8,4, akan berubah warna dari merah menjadi kuning ketika titik ekuivalen tercapai.
Pemilihan jenis indikator yang tepat sangat penting dalam titrasi asam basa agar hasil yang diperoleh akurat dan terpercaya. Oleh karena itu, pemilihan indikator yang sesuai dengan rentang pH larutan sangatlah krusial dalam titrasi asam basa.
Tahap-tahap Titrasi Asam Basa
Persiapan Larutan Standar
Larutan standar merupakan larutan dengan konsentrasi yang diketahui dan digunakan sebagai pembanding dalam titrasi asam basa. Persiapan larutan standar sangat penting dalam titrasi asam basa, agar konsentrasi larutan standar yang digunakan dapat diketahui dengan pasti.
Langkah awal dalam persiapan larutan standar adalah menimbang zat padat yang akan dilarutkan dalam air. Kemudian, zat padat tersebut dilarutkan dalam air yang diukur volumenya dengan akurat, menggunakan labu ukur. Setelah itu, larutan standar dihomogenkan dengan cara mengaduknya secara merata. Dalam beberapa kasus, larutan standar juga dapat dipersiapkan dengan cara mencampurkan larutan yang diketahui konsentrasinya dengan larutan pelarut yang sesuai.
Pada akhirnya, konsentrasi larutan standar harus dihitung dengan teliti dan akurat untuk memastikan keakuratan dalam proses titrasi asam basa. Persiapan larutan standar yang tepat akan membantu memastikan keakuratan dan kepercayaan dalam hasil titrasi yang diperoleh.
Persiapan Larutan Sampel
Larutan sampel adalah larutan yang akan dititrasi dengan larutan standar dalam titrasi asam basa. Persiapan larutan sampel menjadi sangat penting karena akan memengaruhi hasil titrasi yang diperoleh.
Pertama-tama, larutan sampel harus diambil dengan menggunakan teknik pengambilan sampel yang benar dan diambil dalam jumlah yang cukup agar hasil titrasi dapat diandalkan. Setelah itu, larutan sampel ditambahkan ke dalam erlenmeyer, yang kemudian dilengkapi dengan indikator titrasi yang sesuai dengan rentang pH larutan sampel. Sebelum titrasi dimulai, pH larutan sampel harus diperiksa menggunakan pH meter atau kertas lakmus untuk memastikan bahwa pH larutan sampel berada dalam rentang pH yang sesuai dengan indikator yang akan digunakan.
Larutan sampel kemudian dapat dititrasi dengan larutan standar dengan menggunakan buret, yang diambil sedikit demi sedikit sampai titik ekuivalen tercapai. Persiapan larutan sampel yang benar akan membantu memastikan keakuratan dan kepercayaan dalam hasil titrasi yang diperoleh.
Pelaksanaan Titrasi
Pelaksanaan titrasi asam basa membutuhkan ketelitian dan kehati-hatian dalam setiap tahapannya untuk memperoleh hasil yang akurat dan terpercaya. Tahapan pertama adalah mempersiapkan larutan standar dan larutan sampel yang akan dititrasi. Kemudian, larutan sampel dimasukkan ke dalam erlenmeyer dan ditambahkan indikator titrasi yang sesuai. Setelah itu, larutan standar dimasukkan ke dalam buret dan dititrasi ke dalam erlenmeyer yang berisi larutan sampel.
Pada awalnya, titrasi akan menghasilkan perubahan warna indikator yang biasanya berubah secara bertahap. Namun, saat titik ekuivalen tercapai, indikator akan mengalami perubahan warna yang tiba-tiba dan ini menandakan bahwa titrasi telah selesai.
Volume larutan standar yang digunakan dalam titrasi dicatat untuk menghitung konsentrasi larutan sampel yang dititrasi. Selain itu, pengukuran pH larutan sampel sebelum dan setelah titrasi juga dapat dilakukan untuk memastikan keakuratan dalam hasil titrasi. Pelaksanaan titrasi yang benar akan membantu memastikan keakuratan dan kepercayaan dalam hasil titrasi yang diperoleh.
Penentuan Titik Akhir
Penentuan titik akhir merupakan tahap kritis dalam titrasi asam basa yang memengaruhi akurasi hasil titrasi yang diperoleh. Titik akhir merupakan titik di mana jumlah larutan standar yang ditambahkan sudah cukup untuk mereaksikan semua senyawa yang ada dalam larutan sampel. Saat mencapai titik akhir, larutan sampel akan mengalami perubahan warna indikator titrasi yang tiba-tiba, menandakan bahwa titrasi telah selesai. Penggunaan indikator yang tepat dan pengamatan yang seksama saat titrasi akan membantu dalam penentuan titik akhir yang akurat. Penentuan titik akhir yang tepat dan akurat akan memastikan keakuratan dan kepercayaan dalam hasil titrasi yang diperoleh.
Pengolahan Data
Setelah titrasi selesai dilakukan, langkah selanjutnya adalah pengolahan data yang diperoleh. Data yang diperlukan dalam titrasi asam basa adalah volume larutan standar yang digunakan, konsentrasi larutan standar, volume larutan sampel yang digunakan, dan hasil pengukuran pH. Pengolahan data dilakukan dengan menggunakan rumus stoikiometri dan hukum reaksi untuk menghitung konsentrasi larutan sampel yang dititrasi. Konsentrasi larutan sampel dihitung dengan mengalikan volume larutan standar yang digunakan dengan konsentrasi larutan standar, kemudian dibagi dengan volume larutan sampel yang digunakan.
Selain itu, perhitungan pH larutan sampel sebelum dan sesudah titrasi juga dilakukan untuk memastikan keakuratan dalam hasil titrasi. Data yang telah diolah dapat dianalisis untuk memperoleh informasi mengenai sifat asam basa senyawa yang dititrasi. Pengolahan data yang benar dan teliti akan membantu memastikan keakuratan dan kepercayaan dalam hasil titrasi yang diperoleh.
Tips dalam menentukan titik akhir
Menentukan titik akhir adalah salah satu tahapan penting dalam titrasi asam basa yang memerlukan ketelitian dan kejelian. Terdapat beberapa tips yang dapat membantu dalam menentukan titik akhir secara akurat. Pertama, pemilihan indikator titrasi yang tepat sangat penting untuk memastikan titik akhir dapat ditentukan dengan akurat. Indikator titrasi harus dipilih berdasarkan jenis senyawa yang akan dititrasi dan titik akhir yang diharapkan. Kedua, pengamatan yang cermat selama proses titrasi harus dilakukan untuk menghindari kesalahan dalam menentukan titik akhir. Hal ini dapat dilakukan dengan cara melambatkan laju penambahan larutan standar saat mendekati titik akhir.
Ketiga, pengulangan titrasi beberapa kali dapat membantu meningkatkan akurasi dalam menentukan titik akhir. Hal ini sangat penting terutama jika titik akhir yang diharapkan sangat sulit untuk ditentukan dengan tepat. Keempat, pastikan alat yang digunakan dalam titrasi sudah dikalibrasi dan bersih untuk menghindari kesalahan yang dapat mempengaruhi hasil titrasi. Dengan memperhatikan tips-tips di atas, diharapkan titik akhir dapat ditentukan dengan akurat sehingga hasil titrasi yang diperoleh dapat diandalkan.
Tips dalam membuat larutan standar dan larutan sampel
Membuat larutan standar dan larutan sampel dalam titrasi asam basa memerlukan ketelitian dan kejelian agar konsentrasi larutan yang dibuat dapat sesuai dengan yang diharapkan. Terdapat beberapa trik yang dapat membantu dalam membuat larutan standar dan larutan sampel secara akurat. Pertama, pastikan bahan kimia yang digunakan dalam pembuatan larutan sudah memiliki kualitas yang baik dan murni. Hal ini dapat mempengaruhi konsentrasi larutan yang dihasilkan. Kedua, pastikan menggunakan alat yang bersih dan terkalibrasi dengan baik, seperti gelas ukur dan pipet yang akurat, untuk mengukur volume bahan kimia yang digunakan.
Ketiga, perhatikan suhu dan kelembapan saat membuat larutan, karena perubahan suhu dan kelembapan dapat mempengaruhi konsentrasi larutan. Keempat, pastikan bahan kimia yang digunakan sudah terlarut secara merata dengan cara mengaduk secara perlahan dan merata selama proses pembuatan larutan. Kelima, pastikan larutan standar dan larutan sampel sudah dicampur dengan benar sebelum digunakan dalam proses titrasi.
Hal-hal yang perlu diperhatikan saat melakukan titrasi
Titik akhir yang akurat adalah kunci dalam titrasi asam basa, namun terdapat beberapa hal yang perlu diperhatikan selama proses titrasi untuk menghindari kesalahan yang dapat mempengaruhi hasil titrasi. Pertama, pastikan semua peralatan yang digunakan dalam titrasi sudah terkalibrasi dengan baik, dan bersih dari kotoran dan residu kimia sebelum digunakan. Hal ini dapat mempengaruhi konsistensi hasil titrasi. Kedua, pastikan suhu lingkungan dan kelembapan stabil selama proses titrasi, karena perubahan suhu dan kelembapan dapat mempengaruhi hasil titrasi. Ketiga, pastikan larutan standar dan larutan sampel sudah dicampur dengan benar sebelum digunakan dalam proses titrasi.
Keempat, pastikan indikator titrasi yang digunakan sesuai dengan senyawa yang dititrasi dan titik akhir yang diharapkan. Kelima, pastikan laju penambahan larutan standar ke larutan sampel selama proses titrasi berlangsung konstan dan perlahan. Hal ini akan memudahkan pengamatan titik akhir dengan akurat. Terakhir, pastikan pengamatan dan pengukuran selama proses titrasi dilakukan dengan cermat dan teliti, dan pastikan data hasil titrasi dicatat dengan benar. Dengan memperhatikan hal-hal di atas, diharapkan kesalahan selama proses titrasi dapat diminimalkan dan hasil titrasi yang akurat dapat dicapai.
Pentingnya Titrasi Asam Basa dalam berbagai bidang
Titrasi asam basa merupakan metode analisis kimia yang sangat penting dalam berbagai bidang, baik di laboratorium maupun di industri. Salah satu contoh penerapannya adalah dalam bidang farmasi, dimana titrasi asam basa digunakan untuk menentukan konsentrasi bahan aktif dalam obat-obatan. Di bidang makanan, titrasi asam basa digunakan untuk mengukur tingkat keasaman dalam bahan makanan dan minuman, sehingga dapat mempengaruhi rasa dan kualitas produk. Di bidang industri, titrasi asam basa digunakan untuk mengukur konsentrasi asam dan basa dalam larutan industri, dan untuk menentukan kandungan garam dalam air.
Selain itu, titrasi asam basa juga digunakan dalam bidang lingkungan untuk mengukur tingkat keasaman dalam air limbah dan tanah. Dalam bidang akademis, titrasi asam basa merupakan salah satu teknik dasar yang diajarkan dalam pelajaran kimia, karena teknik ini sangat penting dalam menentukan konsentrasi larutan kimia. Dengan begitu, pentingnya titrasi asam basa tidak hanya terbatas pada bidang-bidang tertentu, namun juga di berbagai sektor dan menjadi fondasi penting dalam banyak aplikasi kimia.


Tidak ada komentar:
Posting Komentar