Ikatan hidrogen adalah salah satu konsep penting dalam kimia. Dalam artikel ini, kita akan membahas apa itu ikatan hidrogen, bagaimana ia terbentuk, dan mengapa ia penting dalam berbagai aspek kehidupan.
Pengertian Ikatan Hidrogen
Ikatan hidrogen adalah salah satu jenis ikatan antara atom di mana elektron terbagi secara tidak merata antara dua atom. Dalam ikatan hidrogen, terdapat interaksi elektrostatik antara muatan positif dari atom hidrogen dengan muatan negatif dari atom lain seperti nitrogen, oksigen, atau fluorin. Ikatan hidrogen sering kali terjadi di dalam molekul seperti air (H2O) dan DNA.
Cara Terbentuknya Ikatan Hidrogen
Ikatan hidrogen terbentuk ketika atom hidrogen yang terikat dengan atom lain seperti nitrogen, oksigen, atau fluorin, menarik elektron yang dibagikan dengan atom lain tersebut. Hal ini terjadi karena atom hidrogen memiliki muatan positif yang kuat dan elektronnya hanya terikat dengan inti atom dengan sedikit gaya tarik. Oleh karena itu, elektron dalam ikatan hidrogen cenderung lebih dekat dengan atom lain yang menarik elektronnya, sehingga memunculkan muatan negatif pada atom lain tersebut.
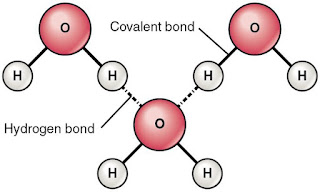
Contoh Ikatan Hidrogen dalam Molekul Air
Molekul air (H2O) terdiri dari dua atom hidrogen yang terikat dengan satu atom oksigen. Dalam molekul ini, atom oksigen menarik elektron yang dibagikan dengan atom hidrogen sehingga atom hidrogen mengalami defisit elektron dan menjadi bermuatan positif. Sementara itu, atom oksigen memiliki kelebihan elektron dan menjadi bermuatan negatif. Karena muatan yang berbeda ini, terjadi interaksi elektrostatik yang kuat antara atom hidrogen dan atom oksigen, membentuk ikatan hidrogen yang mempertahankan molekul air bersama-sama.
Manfaat Ikatan Hidrogen
Ikatan hidrogen memiliki banyak manfaat dalam kehidupan sehari-hari. Beberapa manfaat ikatan hidrogen antara lain:
Pentingnya Ikatan Hidrogen dalam Kehidupan Makhluk Hidup
Ikatan hidrogen sangat penting dalam kehidupan makhluk hidup. Molekul DNA, misalnya, mengandung banyak ikatan hidrogen yang mempertahankan struktur heliks ganda molekul tersebut. Selain itu, ikatan hidrogen juga memainkan peran penting dalam struktur protein dan mempertahankan struktur tiga dimensi molekul tersebut.
Ikatan Hidrogen dalam Pembentukan Air
Air adalah senyawa yang sangat penting bagi kehidupan manusia. Tanpa ikatan hidrogen, molekul air tidak akan terbentuk. Air sangat penting untuk kehidupan manusia dan hewan, serta untuk mempertahankan kondisi lingkungan yang tepat untuk kehidupan tumbuhan.
Ikatan Hidrogen dalam Pemrosesan Makanan
Ikatan hidrogen juga penting dalam pemrosesan makanan. Banyak bahan makanan mengandung molekul dengan ikatan hidrogen yang kuat, seperti protein dan karbohidrat. Dalam pemrosesan makanan, ikatan hidrogen dapat diputuskan dan molekul-molekul tersebut dapat dipecah menjadi senyawa-senyawa yang lebih sederhana. Hal ini memungkinkan kita untuk menghasilkan bahan makanan yang lebih bervariasi dan lebih mudah dicerna oleh tubuh.
Ikatan Hidrogen dalam Industri
Ikatan hidrogen juga memiliki aplikasi dalam berbagai industri, terutama dalam produksi bahan kimia. Ikatan hidrogen dapat membentuk senyawa-senyawa yang sangat penting seperti asam sulfat, amonia, dan banyak lagi. Selain itu, ikatan hidrogen juga digunakan dalam produksi bahan bakar fosil dan energi alternatif.
Dalam akhir artikel ini, semoga dapat memberikan informasi yang berguna bagi pembaca dalam memahami konsep ikatan hidrogen dan pentingnya peranannya dalam berbagai aspek kehidupan. Teruslah mencari informasi dan belajar untuk meningkatkan pengetahuan dan pemahaman kita tentang dunia yang luar biasa ini. Terima kasih telah membaca artikel ini.



Tidak ada komentar:
Posting Komentar