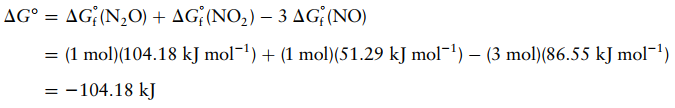Oksida nitrogen merupakan salah satu jenis polutan udara yang dapat membahayakan kesehatan dan ekosistem karena dapat menyebabkan gangguan pernafasan, hujan asam, efek rumah kaca, dll. Reaksi antara oksida nitrogen dapat menghasilkan gas N2 dan O2 yang tidak berbahaya. Berikut adalah diagram tingkat energi reaksi beberapa oksida nitrogen.
Diketahui
data-data termodinamika sebagai berikut (subskrip angka merujuk pada diagram di
atas).
∆H10 = 182,6
kJ/mol
∆H20 = 66,4 kJ/mol
∆H50 = -101 kJ/mol
∆G10 = 175,2 kJ/mol
∆G20 = 102,6 kJ/mol
∆G50 = -71,5 kJ/mol
(i)
Nilai ∆𝐻𝑓0 N2O(g) adalah ….. kJ/mol. [poin 2] Reaksi yang
sesuai dengan nilai tersebut ditunjukkan oleh no. …… [poin 1]
Penyelesaian:
Nilai
∆𝐻𝑓0 N2O(g) adalah 81,6 kJ/mol kJ/mol. Reaksi
yang sesuai dengan nilai tersebut ditunjukkan oleh no. 4
∆𝐻𝑓0 N2O(g) adalah entalpi pembentukan 1 mol N2O(g) dari unsur-unsurnya:
N2(g) + 1/2O2(g) → N2O(g)
Reaksi ini sesuai dengan reaksi (4)
Reaksi
(4):
N2(g) + 2O2(g) → N2O(g) + 3/2O2(g)
pada ruas kiri terdapat 2 mol O2(g) sedangkan pada ruas kanan terdapat 3/2O2(g). Reaksi ini bisa disederhanakan menjadi:
N2(g) + 1/2O2(g) → N2O(g)
Reaksi (4) merupakan penjumlahan dari reaksi (1) dan
(5), maka:
∆𝐻𝑓0 N2O(g) = ∆H10 + ∆H50 = 182,6
kJ/mol + (-101 kJ/mol) = 81,6 kJ/mol
(ii)
Salah satu reaksi antara oksida nitrogen yang dapat terjadi adalah
𝑁2𝑂(𝑔) + 𝑁𝑂2(𝑔) → 3/2𝑁2(𝑔) + 3/2𝑂2(𝑔)
a.
∆𝐻0 reaksi tersebut adalah…. kJ/mol. [poin 3]
b.
∆𝐺0 reaksi tersebut adalah…. kJ/mol. [poin 3]
c.
∆𝑆0 alam semesta untuk reaksi tersebut
pada T = 250C adalah…..
J/(mol.K). [poin
4]
d.
Nilai tetapan kesteimbangan (K) reaksi tersebut pada T = 250C adalah …… [poin 3]
Penyelesaian:
a. Untuk mendapatkan nilai ∆H0 reaksi tersebut, kita dapat menggunakan data
reaksi (2) dan (4)
Reaksi
(2):
N2(g)
+ 2O2(g) → 2NO2(g) ∆H20 = 66,4 kJ/mol (dibalik dan dikali ½)
NO2(g) → 1/2N2(g)
+ O2(g) ∆H0 = -33,2 kJ/mol
Reaksi
(4):
N2(g)
+ 2O2(g) → N2O(g) + 3/2O2(g) ∆H40 = 81,6
kJ/mol (dibalik)
N2O(g) + 3/2O2(g) → N2(g)
+ 2O2(g) ∆H0 = -81,6
kJ/mol
Kemudian reaksi tersebut dijumlahkan:
NO2(g) → 1/2N2(g)
+ O2(g) ∆H0 = -33,2 kJ/mol
N2O(g) + 3/2O2(g) → N2(g)
+ 2O2(g) ∆H0 = -81,6
kJ/mol
---------------------------------------------------------------------------
+
N2O(g) + NO2(g) → 3/2N2(g)
+ 3/2O2(g) ∆H0 = -114,8
kJ/mol
b. Untuk mendapatkan nilai ∆G0 reaksi tersebut, kita dapat menggunakan data
reaksi (2) dan (4)
Karena data nilai ∆G0 reaksi (4) belum ada, maka kita perlu
mencari terlebih dahulu nilai ∆G0 reaksi (4). Reaksi (4) merupakan penjumlahan dari reaksi (1) dan (5), maka:
∆G40 = ∆G10 + ∆G50 = 175,2
kJ/mol + (-71,5 kJ/mol) = 103,7 kJ/mol
Setelah
mendapatkan nilai ∆G40, kita
lanjutkan dengan mencari nilai ∆G0 reaksi yang
ditanyakan:
Reaksi
(2):
N2(g)
+ 2O2(g) → 2NO2(g) ∆G20 = 102,6 kJ/mol (dibalik dan dikali ½)
NO2(g) → 1/2N2(g)
+ O2(g) ∆G0 = -51,3 kJ/mol
Reaksi
(4):
N2(g)
+ 2O2(g) → N2O(g) + 3/2O2(g) ∆G40 = 103,7
kJ/mol (dibalik)
N2O(g) + 3/2O2(g) → N2(g)
+ 2O2(g) ∆G0 = -103,7
kJ/mol
Kemudian reaksi tersebut dijumlahkan:
NO2(g) → 1/2N2(g)
+ O2(g) ∆G0 = -51,3 kJ/mol
N2O(g) + 3/2O2(g) → N2(g)
+ 2O2(g) ∆G0 = -103,7
kJ/mol
---------------------------------------------------------------------------
+
N2O(g) + NO2(g) → 3/2N2(g)
+ 3/2O2(g) ∆G0 = -155,0
kJ/mol
c. ∆G0 = ∆H0 - T∆S0
-155,0 kJ/mol = -114,8
kJ/mol – (298 K) ∆S0
(298
K) ∆S0 = -114,8 kJ/mol + 155,0 kJ/mol = 40,2 kJ/mol
∆S0
= (40,2 kJ/mol) / (298 K)
∆S0
= 0,1349 kJ/mol.K = 134,9 J/mol.K
d ln K = - ΔGo/(RT) = -(-155,0 J.mol-1)/(8,315
J.mol-1.K-1 x 298 K) = 0,062554