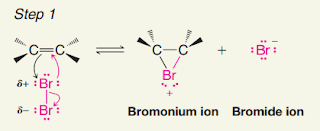
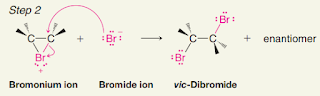
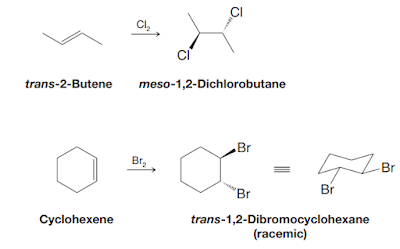
Kayu manis (Cinnamon burmanni Blume) merupakan salah satu jenis rempah-rempah di Indonesia dengan beragam manfaat dari genus Cinnamomum (famili Lauraceae). Kedua senyawa dibawah ini terkandung di dalam ekstrak kulit batang kayu manis.
Petunjuk
: pilih 1 jawaban yang tepat dari opsi yang tersedia
(i) Senyawa A dapat diubah menjadi senyawa B menggunakan reagen dan kondisi….[poin 3] (bisa lebih dari 1
pilihan)
a. 1. H2 (2 atm, 600C)/katalis Pt; 2. CH3COOH
b. 1. NaBH4 dalam metanol; 2. H3O+; 3. Asetil klorida
c. 1. H3O+; 2. KMnO4, kalor
d. 1. H2 (1 atm, 250C)/katalis Pd/C; 2. CH3COOH
e. 1. NaOH, H2O; 2. PCC
f. Tidak tahu
Penyelesaian: e. 1.
NaOH, H2O; 2. PCC
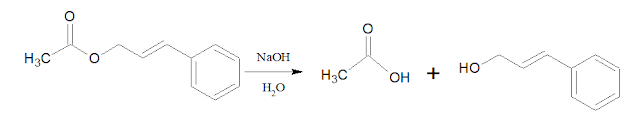
Untuk mengubah senyawa A menjadi senyawa B dapat dilakukan
melalui 2 tahap reaksi. Tahap pertama yaitu dengan menghidrolisis senyawa A
menggunakan pereaksi NaOH, H2O menghasilkan asam etanoat dan suatu alkohol
Kemudian
dilanjutkan dengan mengoksidasi senyawa alkohol yang dihasilkan menggunakan
oksidator PCC. Gugus alcohol akan teroksidasi menjadi aldehida.
(ii) Reaksi antara reagen (CH3)2Cd dengan senyawa A akan dominan terjadi pada
gugus….[poin 2]
a. Ester dan fenil
b. Alkena saja
c. Ester saja
d. Fenil saja
e. Ester dan alkena
f. Tidak tahu
g. Fenil dan alkena
Penyelesaian: e.
ester dan alkena
(iii) Yang ketika diproses lebih lanjut dengan larutan asam akan menghasilkan
dua senyawa dengan deskripsi yang paling tepat….[poin 4]
a. Tidak tahu
b. Salah satu senyawa mengandung gugus keton dan senyawa satunya lagi
mengandung gugus alkohol primer
c. Salah satu senyawa mengandung gugus karboksilat dan senyawa satunya lagi
mengandung gugus alkohol primer
d. Kedua senyawa mengandung gugus metil pada cincin fenil
e. Salah satu senyawa mengandung gugus karboksilat dan senyawa satunya lagi
mengandung gugus alkohol sekunder
f. Salah satu mengandung gugus metil pada cincin fenil dan senyawa satunya lagi
mengandung gugus metil pada karbon benzilik
g. Kedua senyawa mengandung gugus metil pada karbon benzilik
h. Salah satu senyawa mengandung gugus keton dan senyawa satunya lagi mengandung
gugus alkohol sekunder
Penyelesaian: c. Salah
satu senyawa mengandung gugus karboksilat dan senyawa satunya lagi mengandung
gugus alkohol primer
Senyawa A ketika
direaksikan dengan larutan asam, maka akan terjadi reaksi hidrolisis dimana
akan terbentuk dua senyawa yang mengandung gugus karboksilat dan alcohol primer
sebagaimana pada bagian (i)
(iv) Tahapan reaksi yang paling tepat untuk memasukkan gugus -CH2CH2CH3 pada gugus fenil dalam senyawa A adalah dengan reagen dan kondisi….[poin 3]
a. Propil
klorida/AlCl3
b. 1. Propanoil
klorida/AlCl3; 2. Zn(Hg), HCl, kalor
c. Tidak tahu
d. CH2=CH-CH2Br/FeBr3
e. Isopropil
klorida/AlCl3
f. 1. Isopropanoil
bromida/FeBr3; 2. NH2NH2 3. KOH, kalor
g. 1. Asam asetat; 2. SOCl2; 3. (CH3)2MgBr; 4. H3O+
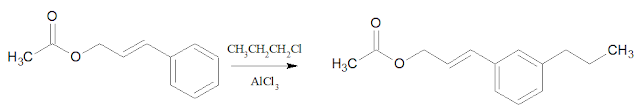
Penyelesaian: a. Propil klorida/AlCl3
Untuk memasukkan
gugus -CH2CH2CH3 pada gugus fenil dalam senyawa A dapat digunakan pereaksi propil klorida menggunakan katalis AlCl3,
reaksi ini disebut reaksi alkilasi.
(v) Ketika senyawa A direaksikan dengan HOBr (asam
hipobromit), maka akan terbentuk senyawa X dengan….[poin 4]
a. Gugus -OH
terikat pada karbon benzilik dan gugus -Br terikat pada karbon alkil sebelahnya
b. Kedua gugus -OH dan -Br tersubstitusi pada cincin fenil di posisi orto dan para terhadap substituen yang sudah ada
c. Tidak tahu
d. Gugus -OH terikat pada cincin fenil dan gugus -Br terikat pada karbon
benzilik
e. Gugus -Br terikat pada cincin fenil dan gugus -OH terikat pada karbon
benzilik
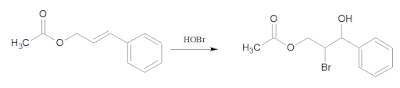
Penyelesaian: a.
Gugus -OH terikat pada karbon benzilik dan gugus -Br terikat pada karbon alkil sebelahnya
Ketika senyawa A direaksikan dengan HOBr (asam
hipobromit), maka akan terjadi adisi pada gugus alkena.
(vi) Senyawa X tersebut memiliki …. Atom C kiral, sehingga maksimum memiliki ….
Stereoisomer. [poin masing-masing 2]
Penyelesaian: 2 atom C kiral, 4 stereoisomer.
Senyawa X memiliki 2 atom C kiral yaitu pada atom C yang
mengikat gugus -Br dan –OH (ditandai dengan tanda *)
Jumlah stereoisomer dapat dihitung dengan rumus 2n,
dengan n=jumlah atom C kiral. Sehingga:
Jumlah stereoisomer = 22 = 4 stereoisomer
(vii) Ketika
senyawa A direaksikan dengan reagen dan kondisi
reaksi (1. H2, katalis Pd/C, 1 atm, 250C; 2. LiAlH4; 3. H+/H2O) maka reaksi akan terjadi pada gugus
fungsi…[poin 3]
a. Alkena saja
b. Karbonil ester saja
c. Cincin fenil saja
d. Alkena, cincin fenil dan karbonil ester
e. Alkena dan cincin fenil
f. Tidak tahu
g. Karbonil ester dan cincin fenil
h. Alkena dan karbonil ester
Penyelesaian: h.
alkena dan karbonil ester
Pereaksi H2
dengan katalis Pd/C dapat memutuskan ikatan rangkap pada alkena. Sedangkan pereaksi
LiAlH4 dan H+/H2O dapat mereduksi gugus ester
menjadi dua senyawa yang masing-masing memiliki gugus alkohol.
(viii) Perkirakan sinyal proton yang akan muncul pada spektrum 1H-NMR senyawa A
adalah….[poin 3]
Penyelesaian: 7
sinyal proton
Senyawa A memiliki
7 lingkungan proton yang berbeda, maka akan muncul 7 sinyal pada spectrum 1H-NMR