Pendahuluan
Reaksi adisi alkena adalah salah satu reaksi kimia penting dalam kimia organik. Reaksi ini terjadi ketika alkena bereaksi dengan senyawa lain dan menghasilkan senyawa baru yang lebih kompleks. Reaksi ini sering digunakan dalam sintesis senyawa organik dan menjadi topik yang menarik untuk dibahas dalam dunia kimia organik. Dalam artikel ini, kita akan membahas definisi, jenis, dan contoh dari reaksi adisi alkena.
Reaksi adisi alkena adalah reaksi kimia di mana atom atau molekul ditambahkan ke gugus rangkap dua atau alkena. Reaksi ini menghasilkan senyawa baru yang lebih kompleks dengan gugus fungsional baru.
Jenis Reaksi Adisi Alkena
Reaksi Hidrogenasi
Adisi hidrogenasi adalah reaksi kimia yang melibatkan penambahan hidrogen (H2) ke dalam suatu senyawa organik yang memiliki ikatan rangkap, seperti alkena. Reaksi ini umumnya terjadi dalam keadaan katalitik dan dapat dilakukan pada kondisi tekanan dan suhu tertentu.
Mekanisme reaksi adisi hidrogenasi pada alkena melibatkan dua tahap reaksi. Tahap pertama adalah adsorpsi molekul hidrogen di atas permukaan katalis, yang umumnya menggunakan logam seperti platinum (Pt), palladium (Pd), atau nickel (Ni) sebagai katalis. Tahap kedua melibatkan migrasi elektron dari ikatan rangkap ke atom hidrogen yang diadsorpsi, sehingga terbentuk ikatan tunggal antara dua atom karbon yang semula memiliki ikatan rangkap. Tahap kedua ini disebut reduksi.
Contoh reaksi adisi hidrogenasi pada alkena adalah reaksi etena (C2H4) dengan hidrogen (H2) untuk menghasilkan etana (C2H6), dengan menggunakan katalis platinum (Pt):
C2H4+ H2 -> C2H6
Adisi hidrogenasi memiliki banyak aplikasi dalam industri kimia, termasuk produksi bahan bakar dan bahan kimia yang digunakan dalam proses pembuatan plastik, resin, dan bahan kimia lainnya. Reaksi ini juga digunakan dalam sintesis senyawa organik yang lebih kompleks, dan dianggap sebagai reaksi yang sangat penting dalam kimia organik.
Reaksi Hidrohalogenasi
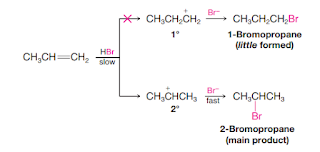
Reaksi adisi alkena oleh asam halida adalah suatu reaksi kimia yang melibatkan penambahan asam halida (misalnya asam klorida, HCl atau asam bromida, HBr) ke dalam alkena untuk membentuk senyawa haloalkana. Reaksi ini terjadi dengan cara penambahan ion H+ dari asam halida ke salah satu karbon alkena dan ion halida (misalnya Cl- atau Br-) ke karbon alkena yang lain, sehingga ikatan rangkap pada alkena terurai dan membentuk ikatan tunggal pada senyawa hasil reaksi.
Contoh reaksi adisi alkena oleh asam halida adalah reaksi propena dengan asam bromida (HBr) yang menghasilkan senyawa 2-kloropropana:
Reaksi Hidrasi
Reaksi adisi hidrasi alkena adalah reaksi kimia di mana suatu alkena bereaksi dengan air (H2O) dalam kehadiran katalis asam untuk membentuk alkohol. Proses ini melibatkan penambahan molekul air pada ikatan rangkap ganda (C=C) pada alkena dan menghasilkan produk alkohol.
Secara umum, reaksi ini terdiri dari dua tahap. Tahap pertama adalah penambahan proton (H+) pada ikatan rangkap ganda alkena untuk membentuk karbokation yang stabil. Kemudian, pada tahap kedua, molekul air ditambahkan ke karbokation yang terbentuk untuk membentuk alkohol.
Berikut adalah persamaan umum untuk reaksi adisi hidrasi alkena:
RCH=CH2 + H2O + H+ → RCH2-CH2OH
Dalam persamaan tersebut, R dapat diwakili oleh gugus fungsional atau atom hidrogen lainnya yang terikat pada atom karbon.
Reaksi adisi hidrasi alkena sangat penting dalam industri kimia karena memungkinkan produksi alkohol dari alkena yang tersedia secara komersial. Selain itu, reaksi ini juga digunakan dalam sintesis organik untuk memproduksi senyawa organik yang lebih kompleks.
Contoh
Reaksi Adisi Bromida dan Klorida
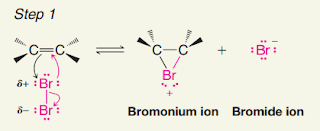
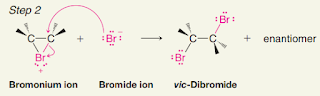
Reaksiadisi bromida dan klorida pada alkena adalah reaksi kimia di mana alkena bereaksi dengan bromin atau klorin untuk membentuk senyawa alifatik dengan ikatan rangkap ganda alkena yang telah tergantikan oleh atom bromin atau klorin. Reaksi ini disebut juga reaksi adisi elektrofilik karena atom bromin atau klorin bertindak sebagai elektrofil (penerima pasangan elektron) dalam reaksi.
Secara umum, reaksi adisi bromida dan klorida pada alkena terdiri dari dua tahap. Tahap pertama adalah pembentukan intermediet bromonium atau kloronium yang stabil, yang terbentuk saat atom bromin atau klorin menyerang ikatan rangkap ganda alkena dan mengikat ke salah satu atom karbon dalam ikatan rangkap ganda. Kemudian, pada tahap kedua, ion bromida atau klorida ditambahkan ke intermediet bromonium atau kloronium untuk membentuk senyawa alifatik yang baru.
Berikut adalah persamaan umum untuk reaksi adisi bromida dan klorida pada alkena:
Alkena+ Br2 atau Cl2 → Brominium atau kloronium intermediet → Senyawa alifatik dengan atom bromin atau klorin terikat
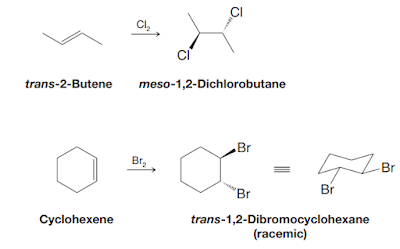
Contoh reaksi adisi bromin dan klorin pada alkena adalah sebagai berikut:
Reaksi adisi bromida dan klorida pada alkena penting dalam sintesis organik karena memungkinkan pembentukan senyawa organik yang lebih kompleks dari alkena yang relatif sederhana. Selain itu, reaksi ini juga digunakan dalam industri kimia untuk produksi bahan kimia penting seperti polimer, obat-obatan, dan bahan kimia lainnya.
Reaksi Pembentukan Halohidrin
Reaksi pembentukan halohidrin melalui adisi alkena adalah reaksi kimia di mana suatu alkena bereaksi dengan campuran bromin atau klorin dan air dengan kehadiran katalis asam untuk membentuk senyawa halohidrin. Senyawa halohidrin adalah senyawa organik yang mengandung gugus fungsional halogen dan hidroksil pada atom karbon yang sama.
Reaksi ini melibatkan penambahan molekul bromin (Br2) atau klorin (Cl2) dan air (H2O) pada ikatan rangkap ganda (C=C) pada alkena dan menghasilkan produk halohidrin.
Berikut adalah persamaan umum untuk reaksi pembentukan halohidrin melalui adisi alkena:
Reaksi pembentukan halohidrin melalui adisi alkena dapat diaplikasikan pada berbagai jenis alkena dan juga dapat dilakukan dengan halogen lain seperti klorin. Reaksi ini penting dalam sintesis organik karena dapat menghasilkan senyawa halohidrin yang berguna dalam produksi bahan kimia penting seperti plastik, resin, dan obat-obatan.












.jpg)








