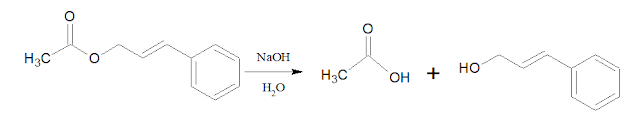
Nilai hasil kali kelarutan untuk garam PbSO4 dapat ditentukan menggunakan sel Galvani. Sel ini disusun menggunakan elektroda kalomel jenuh dan elektroda Pb yang dicelupkan ke dalam larutan PbSO4 jenuh pada 250C sesuai notasi sel berikut:
𝑃𝑏 | 𝑃𝑏2+ (𝑃𝑏𝑆𝑂4 𝑗𝑒𝑛𝑢ℎ) || 𝐾𝐶𝑙 (3,5 𝑀) | 𝐻𝑔2𝐶𝑙2 | 𝐻𝑔
Esel yang diperoleh adalah 0,313 V.
Diketahui E0 Pb2+|Pb
= -0,126 V dan Ekalomel = 0,300 V.
a.
Konsentrasi Pb2+ dalam
larutan PbSO4 jenuh
adalah….. M. [poin 4]
b.
Nilai Ksp PbSO4 adalah …. [poin 3]
Kadar
sulfat dalam sampel alami seperti air laut dan limbah industri dapat ditentukan menggunakan
analisis kuantitatif klasik secara tidak langsung. Metode ini terdiri dari tiga
tahap,
yaitu pengendapan sulfat sebagai PbSO4, pelarutan kembali PbSO4 dalam larutan ammonia
dengan penambahan EDTA berlebih untuk membentuk kompleks PbY2- yang larut, dan
titrasi kelebihan EDTA dengan larutan standar Mg2+ atau larutan standar Zn2+.
Diketahui reaksi dan tetapan kesetimbangan
pada proses tersebut adalah….
𝑃𝑏𝑆𝑂4(𝑠) ⇌ 𝑃𝑏2+(𝑎𝑞) + 𝑆𝑂42-(𝑎𝑞) 𝐾𝑠𝑝 = 1,6 × 10-8
𝑃𝑏2+(𝑎𝑞) + 𝑌4-(𝑎𝑞) ⇌ 𝑃𝑏𝑌2-(𝑎𝑞) 𝐾𝑓 = 1,1 × 1018
𝑀𝑔2+(𝑎𝑞) + 𝑌4-(𝑎𝑞) ⇌ 𝑀𝑔𝑌2-(𝑎𝑞) 𝐾𝑓 = 4,9 × 108
𝑍𝑛2+(𝑎𝑞) + 𝑌4-(𝑎𝑞) ⇌ 𝑍𝑛𝑌2-(𝑎𝑞) 𝐾𝑓 = 3,2 × 1016
c.
Padatan PbSO4 akan …..
dalam larutan Y4- dengan nilai
tetapan kesetimbangan reaksi sebesar …. [poin 3]
d.
Larutan yang lebih baik digunakan sebagai titran adalah ….. karena …… [poin 3]
e.
Pada suatu analisis, 10,00 mL sampel diencerkan hingga 100,0 mL. Kemudian 25,00
mL larutan
ini diambil dan ditambahkan 50,00 mL larutan EDTA 0,0800 M. EDTA yang berlebih
dititrasi
menggunakan larutan standar Mg2+ 0,2400 M dan membutuhkan 13,80 mL
untuk mencapai
titik akhir titrasi. Kadar sulfat pada sampel awal adalah ….. M atau …. ppm. [poin 6]
Penyelesaian:
a. Notasi sel: Pb|Pb2+(PbSO4
jenuh)||KCl(3,5M)|Hg2Cl2|Hg
Reaksi yang berlangsung:
Anoda: Pb(s) → Pb2+(aq) + 2e
Katoda: Hg2Cl2(s)
+ 2e → 2Hg(l) + 2Cl-(aq)
--------------------------------------------------------
+
Reaksi total: Pb(s) + Hg2Cl2(s)
→ Pb2+(aq) + 2Hg(l) + 2Cl-(aq)
E0sel = E0katoda – E0anoda = Ekalomel – EPb|Pb2+ = 0,300 V – (-0,126 V) = 0,426 V
Esel =E0sel – (0,05916/n) log ([Pb2+][Cl-]2)
0,313 = 0,426 – (0,05916/2) log ([Pb2+][3,5])
Solve [Pb2+] = 539,34 M
Nilai ini sebenarnya terlalu besar. Apabila di cek
lagi data elektroda kalomel itu sekitar 0,268-an, ini ternyata berpengaruh
signifikan ketika dibulatkan ke 0,3. apabila digunakan nilai yang lebih akurat
potensial kesetimbangannya bukan 0,426 tetapi 0,394 dan menghasilkan konsentrasi
Pb yang lebih kecil (sekitar 44 M).
Apabila dikoreksi juga nilai potensial (non
kesetimbangannya >0.35, bisa menghasilkan nilai yang cukup masuk akal
b. Nilai Ksp; [Pb2+] yang diperoleh
melalui sel Galvani merupakan banyaknya Pb2+ yang larut dari PbSO4
jenuh, sehingga
[Pb2+] = s = 539,34 M
Ksp PbSO4 = s2 = (539,34)2
= 290.887,6536
Nilai sangat besar dan tidak masuk akal. Nilai Ksp PbSO4
yang sebenarnya adalah 1,6x10-8‑. Hal ini akibat adanya koreksi
nilai potensial seperti yang sudah dijelaskan pada poin (a)
c. Padatan PbSO4 akan larut dalam larutan
Y4-. Nilai tetapan kesetimbangannya adalah:
PbSO4(s) → Pb2+(aq) + SO42-(aq) Ksp = 1,6 x 10-8
Pb2+(aq) + Y4-(aq) → PbY2-(aq) Kf =
1,1 x 1018
------------------------------------------ +
PbSO4(s) + Y4-(aq) → PbY2-(aq) + SO42-(aq) K = Ksp x Kf = 1,76 x 1010
d. Larutan yang lebih baik digunakan
sebagai titran adalah Zn2+ karena berdasarkan nilai Kf, Kf ZnY2-
> Kf MgY2- (artinya ZnY2- merupakan kompleks yan lebih
stabil (mudah terbentuk ketika Zn2+ bertemu dengan kelebihan larutan
Y4- sesedikit apapun).
e. V sampel PbSO4 = 10 mL; diencerkan menjadi 100 mL. Dari 100 mL
diambil 25 mL.
Pb2+
(PbSO4, 25 mL) + EDTA (Y4-) → PbY2-
Mol awal EDTA = 50 ml x 0,08 M = 4 mmol
Mol EDTA sisa = mol Mg2+
yang bereaksi = 13,80 mL x 0,24 M = 3,312 mmol
Mol EDTA yang bereaksi
= 4 mmol – 3,312 mmol = 0,688 mmol (dalam 25 mL)
Mol Pb2+ (dalam 25 mL) = mol EDTA yang bereaksi
=0,688 mmol
Mol Pb2+ (dalam 100 mL) = (100/25) x 0,688 mmol
= 2,752 mmol
Mol Pb2+ (dalam 100 mL) = mol Pb2+ (dalam
10 mL) = 2,752 mmol
Mol Pb2+ (dalam 10 mL) = Mol SO42- (dalam 10
mL) = 2,752 mmol
[SO42-] = 2,752 mmol/10 mL = 0,2752
M
[SO42-] = 0,2752 mol/L = 0,2752 mol x
96 g/mol /L = 26,4192 g/L = 26.419,2 mg /L = 26.419,2 ppm