Contoh Soal Termodinamika
Selamat datang di artikel saya yang akan membahas contoh soal termodinamika yang berguna untuk meningkatkan pemahaman Anda. Termodinamika adalah cabang ilmu fisika yang mempelajari energi dan perubahan yang terjadi pada sistem. Dalam artikel ini, saya telah merangkum 7 contoh soal termodinamika yang menarik dan mudah dipahami, sehingga dapat membantu Anda meningkatkan pemahaman tentang konsep dasar termodinamika. Yuk, simak artikel ini sampai selesai!
Soal 1
Sebuah
silinder mengandung gas sebanyak 2,00 L di bawah tekanan 1,00 atm. Tekanan
eksternal juga sebesar 1,00 atm. Gas tersebut dipanaskan secara perlahan,
dengan piston bergerak bebas ke luar untuk menjaga tekanan gas tetap mendekati 1,00
atm. Anggaplah pemanasan berlanjut hingga mencapai volume akhir sebesar 3,50 L.
Hitunglah kerja yang dilakukan pada gas dan ungkapkan dalam satuan joule.
Solusi:
Ini
adalah sebuah ekspansi sistem dari 2,00 L menjadi 3,50 L melawan tekanan
eksternal konstan sebesar 1,00 atm. Kerja yang dilakukan pada sistem adalah:
W = -Pext
ΔV
dimana
W adalah kerja yang dilakukan, Pext adalah tekanan eksternal, dan ΔV adalah
perubahan volume gas.
Dalam
hal ini, tekanan eksternal adalah konstan sebesar 1,00 atm, dan perubahan
volume adalah ΔV = Vakhir - Vawal = 3,50 L - 2,00 L =
1,50 L. Oleh karena itu, kerja yang dilakukan pada gas adalah:
W =
-1,00 atm x 1,50 L = -1,50 L·atm
Untuk
mengungkapkan ini dalam satuan joule, kita perlu mengonversi dari L·atm ke
joule menggunakan faktor konversi:
1
L·atm = 101,325 J
Jadi
kita memiliki:
W =
-1,50 L·atm x (101,325 J/L·atm) = -152,0 J
Oleh
karena itu, kerja yang dilakukan pada gas selama ekspansi ini adalah -152,0
joule. Tanda negatif menunjukkan bahwa kerja dilakukan pada gas, yang konsisten
dengan fakta bahwa gas sedang mengalami ekspansi melawan tekanan eksternal.
Soal 2
Anggap
sebuah massa 10,00 kg jatuh melalui perbedaan ketinggian 3,00 m, dan hasil
kerjanya digunakan untuk memutar sebuah baling-baling di dalam 200,0 g air,
yang pada awalnya suhunya 15,00°C. Suhu air akhir ternyata menjadi 15,35°C.
Dengan mengasumsikan bahwa kerja yang dilakukan digunakan sepenuhnya untuk
meningkatkan suhu air, hitung faktor konversi antara joule dan kalori.
Solusi:
Langkah
pertama adalah menghitung jumlah kerja yang dilakukan oleh massa ketika jatuh
melalui perbedaan ketinggian 3,00 m. Kerja ini sama dengan perubahan energi
potensial massa, yang diberikan oleh:
W =
mgh
di
mana W adalah kerja yang dilakukan, m adalah massa, g adalah percepatan
gravitasi, dan h adalah perbedaan ketinggian.
Dengan
mengganti nilai yang diberikan, kita peroleh:
W =
(10,00 kg) (9,81 m/s2) (3,00 m) = 294 J
Selanjutnya,
kita perlu menghitung panas yang diserap oleh air akibat kerja ini. Panas yang
diserap sama dengan perkalian massa air, kalor jenis air, dan perubahan suhu.
Kalor jenis air adalah 1 kal/(g°C). Massa air adalah 200,0 g. Perubahan suhu
adalah (15,35 - 15,00)°C = 0,35°C. Oleh karena itu, kita peroleh:
Q =
(200,0 g) (1 kal/(g°C)) (0,35°C) = 70,0 kal
Terakhir,
kita dapat menggunakan faktor konversi antara joule dan kalori untuk menemukan
jawabannya. Satu kalori sama dengan 4,2 joule. Oleh karena itu,
1
kalori = 4,2 J
Dengan
membagi panas yang diserap oleh air dengan faktor konversi, kita mendapatkan:
70 kal x 4,2 J/kal = 294 J
Besarnya kerja yang dilakukan sama dengan besarnya kalor yang diterima oleh air.
Soal 3
Selembar besi dengan massa 72,4 g dipanaskan hingga 100,0°C dan dicelupkan ke dalam air seberat 100,0 g yang pada awalnya berada pada suhu 10,0°C dalam kalorimeter cangkir Styrofoam. Diasumsikan tidak ada panas yang hilang ke cangkir Styrofoam atau lingkungan sekitar. Hitung suhu akhir yang tercapai. (Cair = 4,18 J/g°C dan Cbesi = 0,449 J/g°C)
Solusi:
Untuk
menyelesaikan masalah ini, kita perlu menggunakan persamaan:
q =
mCΔT
di
mana q adalah panas yang ditransfer, m adalah massa zat, C adalah kapasitas
kalor spesifik, dan ΔT adalah perubahan suhu.
Pertama,
kita perlu menghitung panas yang ditransfer dari besi ke air. Panas yang
ditransfer dari besi sama dengan panas yang diserap oleh air:
qbesi
= qair
Kita
dapat menghitung q_besi menggunakan persamaan:
mbesi x Cbesi x ΔTbesi = mair x Cair x ΔTair
72,4 g x 0,449 J/g°C x (100°C - Tf ) = 100,0 g x 4,18 J/g°C x (Tf - 10°C)
3.251 - 32,51Tf = 418Tf - 4180
7431 = 450,51Tf
Tf = 16,5°C
Oleh karena itu, suhu akhir yang tercapai sekitar 16,5°C.
Soal 4
Anggaplah
bahwa 1,00 kJ kalor ditransfer ke 2,00 mol argon (pada 298 K, 1 atm). Berapakah
suhu akhir Tf jika kalor ditransfer (a) pada volume konstan, atau (b) pada
tekanan konstan? Hitunglah perubahan energi, ΔU,
pada setiap kasus.
Solusi:
Karena argon merupakan gas monoatomik, mendekati gas ideal,
Soal 5
Untuk
menguapkan 100,0 g karbon tetraklorida pada titik didih normalnya, 349,9 K, dan
P = 1 atm, dibutuhkan 19,5 kJ panas. Hitung ΔHvap
untuk CCl4 dan bandingkan dengan ΔU
untuk proses yang sama.
Solusi:
Massa molar CCl4 adalah 153,8 g.mol-1 ; sehingga, jumlah mol CCl4 dalam 100 g adalah
Soal 6
Hitunglah
panas dan kerja yang terjadi pada suatu proses di mana 5,00 mol gas mengembang
secara reversibel pada suhu konstan T sebesar 298 K dari tekanan 10,00 hingga
1,00 atm.
Solusi:
Pada suhu konstan T dan n, q dan w diberikan oleh persamaan berikut
Soal 7
Misalkan
5,00 mol gas monoatomik ideal pada suhu awal 298 K dan tekanan 10,0 atm
diperluas secara adiabatik dan reversibel hingga tekanan turun menjadi 1,00 atm.
Hitung volume dan suhu akhir, perubahan energi dan entalpi, serta kerja yang
dilakukan.
Solusi:
Pertama hitung volume awal,




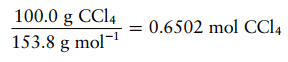




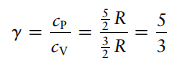
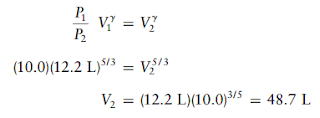
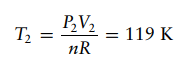
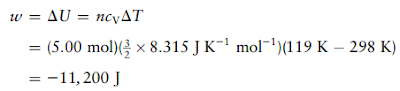



Tidak ada komentar:
Posting Komentar