Asam adalah senyawa yang mengandung satu atau lebih atom hidrogen dapat diganti sebagian atau seluruhnya oleh logam atau ion positif untuk menghasilkan garam. Beberapa teori (konsep) telah diusulkan untuk menjelaskan perilaku asam dan basa berdasarkan struktur dan komposisi, tetapi tidak ada teori tunggal yang menjelaskan perilaku asam dan basa secara keseluruhan. Masing-masing teori atau konsep dapat diterapkan dengan kelebihan dalam keadaan yang sesuai. Dalam situasi tertentu, ahli kimia menggunakan konsep yang paling sesuai dengan tujuannya. Teori atau konsep yang paling populer dijelaskan dalam bab ini.
Konsep Arrhenius
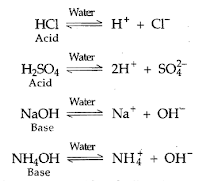
Konsep ini muncul pada tahun 1887. Menurut konsep ini, semua zat yang memberikan ion H+ ketika dilarutkan dalam air disebut asam sedangkan yang terionisasi dalam air melepaskani ion OH- disebut basa.
Sebenarnya ion H+ bebas tidak ada di dalam air. Ion H+ bergabung dengan molekul pelarut (H2O), terhidrasi untuk membentuk hidronium atau ion hidroksinium (H3O+).
H+ + H2O ⇌H3O+
Dengan demikian, ionisasi asam dalam larutan berair harus direpresentasikan sebagai:
HCl + H2O ⇌H3O+(aq) + Cl-(aq)
H2SO4 + 2H2O ⇌2H3O+(aq) + SO42-(aq)
Reaksi antara asam dan basa disebut reaksi netralisasi, dimana ion H+ dari asam dan ion OH- dari basa bereaksi membentuk air (H2O).
NaOH + HCl → NaCl + H2O
(basa) (asam) (garam) (air)
OH- + H+ ⇌ H2O
Keterbatasan Konsep Arrhenius
(i) Konsep Arrhenius hanya berlaku untuk larutan berair. Untuk sifat asam atau basa, keberadaan air benar-benar diperlukan. HCl murni (tidak mengandung air) tidak dapat bertindak sebagai asam karena HCl murni tidak dapat melepaskan ion H+.
(ii) Konsep Arrhenius tidak menjelaskan sifat asam atau basa dalam pelarut bukan air.
(iii) Konsep Arrhenius gagal menjelaskan sifat asam dari senyawa non-protik (tidak memiliki proton) seperti SO2, NO2, CO2 P2O5.; yang tidak memiliki hidrogen untuk melepaskan ion H+.
(iv) Konsep Arrhenius gagal menjelaskan sifat dasar senyawa seperti NH3, Na2CO3, yang tidak memiliki OH dalam molekulnya untuk melepaskan ion OH-.
(v) Konsep Arrhenius gagal menjelaskan sifat asam dari garam-garam tertentu seperti sebagai AICl3 dalam larutan berair.
Konsep Arrhenius yang Dimodifikasi
Konsep yang dimodifikasi memperbaiki sebagian besar keterbatasan. Air adalah elektrolit yang lemah dan terionisasi pada tingkat yang sangat kecil.
Air juga bersifat netral, yaitu konsentrasi ion H3O+ dan OH- sama.
[H3O+] = [OH-]
Zat yang dapat meningkatkan konsentrasi ion H3O+ dalam air maka zat tersebut bertindak sebagai asam sedangkan zat yang meningkatkan konsentrasi ion OH- bertindak sebagai basa. SO2 meningkatkan konsentrasi ion H3O+ dalam air, oleh karena itu, SO2 bersifat asam.
SO2 + H2O → H2SO3 + H2O ⇌H3O+ + HSO3-
Demikian pula, NH3 berperilaku sebagai basa karena meningkatkan konsentrasi ion OH- dalam air.
NH3 + H2O →NH4OH ⇌NH4+ + OH-
Kebasaan Suatu Asam
Kebasaan asam adalah jumlah ion hidrogen yang dapat disediakan oleh satu molekul asam pada saat disosiasi. Asam yang membebaskan ion 1, 2 atau 3 ion H+ masing-masing dikenal sebagai monobasa, dibasa dan tribasa (monoprotik, diprotik dan triprotik). Asam poliprotik biasanya terdisosiasi dalam beberapa tahap.
Jelas, dari tabel di atas bahwa kebasaan suatu asam tidak selalu sama dengan jumlah atom hidrogen yang ada dalam satu molekul asam tetapi jumlah ion hidrogen yang dapat dilepaskan oleh satu molekul. Asam yang melepaskan lebih dari satu ion H+ dalam larutan berair disebut sebagai polibasa atau poliprotik.
Keasamaan Suatu Basa
Keasaman basa adalah jumlah ion hidroksil yang dihasilkan dari satu molekul basa pada disosiasi. Basa yang membebaskan 1, 2 atau 3 ion OH- masing-masing dikenal sebagai monoasam atau monohidroksik, diasam atau dihidroksik, triasam atau trihidroksik. Natrium hidroksida (NaOH), amonium hidroksida (NH4OH), kalium hidroksida (KOH) adalah basa monoasam atau monohidroksik sedangkan kalsium hidroksida [Ca(OH)2] dan barium hidroksida [Ba(OH)2] adalah basa diasam atau dihidroksik.
Kekuatan Asam dan Basa
Kekuatan asam atau basa dalam konsep Arrhenius adalah berdasarkan tingkat ionisasi atau konstanta kesetimbangan.
Konstanta kesetimbangan, Ka untuk asam, HX, adalah:
Konstanta kesetimbangan, Kb untuk basa, BOH, adalah:
Asam yang sangat terionisasi dalam larutan berair, yaitu, memberikan sejumlah besar ion hidrogen dikenal sebagai asam kuat. Nilai Ka untuk asam kuat lebih tinggi dari 0.1. HCIO4, HNO3, H2SO4, HCl, adalah asam yang sangat kuat. Nilai Ka sangat kecil untuk asam lemah seperti CH3COOH, H3PO3, H2CO3, H3BO3, dan lain-lain. Contoh, nilai Ka dari CH3COOH adalah 1,8 x l0-5 pada 25oC. Dengan kata lain, dalam kasus asam lemah, ionisasinya hanya sedikit dan sebagian besar tetap sebagai molekul yang tidak terionisasi.
Basa yang sangat terdisosiasi dalam larutan berair untuk menghasilkan sejumlah besar ion OH- disebut alkali kuat. Nilai Kb untuk alkali kuat lebih tinggi dari 0.1. NaOH, KOH, Ba(OH)2, adalah contoh basa yang kuat. Untuk basa lemah seperti NH40H, Al(OH)3, Fe(OH)3 memiliki nilai Kb rendah.
Konsep Bronsted-Lowry
Konsep ini diusulkan secara sendiri-sendiri oleh Bronsted dan Lowry pada tahun 1923. Menurut konsep ini, asam adalah spesies yang mampu menyumbangkan proton dalam reaksi sementara basa adalah spesies yang mampu menerima proton dalam reaksi, yaitu asam adalah donor proton (protogenik) dan basa adalah akseptor proton (protofilik). Perhatikan reaksi berikut,
HCl + H2O ⇌H3O+ + Cl-
Dalam reaksi ini, HCl bertindak sebagai asam karena menyumbangkan
proton (H+) ke molekul air. Di sisi lain, air berperilaku sebagai basa dengan menerima proton (H+) dari asam. Beberapa contoh lainnya adalah:
CH3COOH + H2O ⇌ H3O+ + CH3COO-
(asam) (basa)
CO2 + 2H2O ⇌ H3O+ + HCO3-
(asam) (basa)
NH4+ + H2O ⇌ H3O+ + NH3
(asam) (basa)
HSO4- + H2O ⇌ H3O+ + SO42-
(asam) (basa)
Perhatikan reaksi berikut,
NH3 + H2O ⇌NH4+ + OH-
Pada reaksi ini, air bertindak sebagai asam karena menyumbangkan proton ke molekul NH3, dan NH3 bertindak sebagai basa karena menerima proton dari H2O.
Beberapa contoh lainnya adalah:
CN- + H2O ⇌ HCN + OH-
(basa) (asam)
NO2- + H2O ⇌HNO2 + OH-
(basa) (asam)
Terbukti dari contoh-contoh di atas bahwa H2O dapat bertindak
sebagai asam maupun basa. Sifat H2O yang demikian disebut sebagai amfiprotik. Selain H2O, NH3 dan CH3COOH juga bersifat amfiprotik.
Ketika asam kehilangan proton, molekul sisa asam memiliki kecenderungan untuk mendapatkan kembali proton. Oleh karena itu, molekul sisa asam tersebut berperilaku sebagai basa (karena bertindak sebagai penerima proton). Contoh:
HCl ⇌ H+ + Cl-
(asam) (basa)
CH3COOH ⇌ H+ + CH3COO-
(asam) (basa)
Ketika asam dan basa bereaksi, maka akan terbentuk pasangan konjugat. Perhatikan reaksi berikut:
CH3COOH + NH3 ⇌ CH3COO- + NH4+
(asam) (basa) (basa) (asam)
Jika pada reaksi di atas, asam, CH3COOH diberi label asam 1 dan basa konjugatnya, CH3COO- sebagai basa 1 dan H2O diberi label sebagai basa 2 dan asam konjugatnya, H3O+ sebagai asam 2, reaksi dapat ditulis sebagai berikut:
Asam 1 + Basa 2 ⇌ Basa 1 + Asam 2
Dengan demikian, setiap reaksi asam-basa melibatkan dua pasangan konjugat, yaitu, ketika asam bereaksi dengan basa, maka akan terbentuk asam dan basa yang lain. Berikut contoh beberapa reaksi yang lain:
H2O + NH3 ⇌ NH4+ + OH-
(asam) (basa) (asam) (basa)
HCN + H2O ⇌ CN- + H3O+
(asam) (basa) (basa) (asam)
HCl + NH3 ⇌ NH4+ + Cl-
(asam) (basa) (asam) (basa)
Setiap asam memiliki basa konjugatnya dan setiap basa memiliki asam konjugatnya.
Keunggulan dari konsep asam basa Bronsted-Lowry yaitu dapat menjelaskan sifat asam basa pada pelarut lain selain air, yang memiliki kecenderungan untuk menerima atau kehilangan proton. Konsep asam basa Bronsted-Lowry juga dapat menentukan perilaku asam atau basa dari zat terlarut dalam pelarut itu. Selain itu, dapat dikatakan bahwa istilah asam atau basa adalah komparatif. Suatu zat dapat bertindak sebagai asam dalam satu pelarut sementara itu berperilaku sebagai basa dalam pelarut lain. Asam asetat bertindak sebagai asam dalam air tetapi berperilaku sebagai basa dalam HF.
Kekuatan Asam dan Basa
Kekuatan asam tergantung pada kecenderungannya untuk kehilangan protonnya dan kekuatan basa tergantung pada kecenderungannya untuk mendapatkan proton. Ka, konstanta kesetimbangan, dari reaksi berikut memberikan ukuran kuantitatif kekuatan asam
HA + H2O ⇌A- + H3O+
Semakin besar nilai Ka menunjukkan bahwa asam tersebut semakin kuat.
Demikian pula, Kb dari reaksi berikut memberikan ukuran kuantitatif kekuatan basa.
B + H2O ⇌BH+ + OH-
Semakin besar nilai Kb menunjukkan bahwa basa tersebut semakin kuat. Lebih lanjut diamati bahwa asam kuat memiliki basa konjugat yang lemah sedangkan asam lemah memiliki basa konjugat yang kuat.
Asam kuat HCl memiliki basa konjugat Cl- yang lemah, sedangkan asam lemah CH3COOH memiliki basa konjugat CH3COO- yang kuat.
Keterbatasan Konsep Asam Basa Brosnted-Lowry
Suatu zat disebut sebagai asam atau basa jika bereaksi dengan zat lain. Jika menyumbangkan proton ke zat lain, maka zat itu adalah asam dan jika menerima proton dari zat lain, zat itu adalah basa. Sedangkan ada sejumlah reaksi asam-basa di mana tidak ada transfer proton yang terjadi. Dengan demikian konsep asam basa Bronsted-Lowry tidak dapat digunakan untuk menjelaskan reaksi-reaksi yang terjadi pada pelarut yang tidak memiliki proton.
Konsep Asam Basa Lewis
Konsep tentang sifat asam-basa yang lebih umum dan mendasar diusulkan oleh G.N. Lewis pada tahun 1923 (tahun yang sama di mana konsep Bronsted diperkenalkan). Namun, konsep tersebut menjadi berpengaruh pada tahun 1930 dan seterusnya. Menurut konsep ini, basa adalah zat yang dapat memberikan sepasang elektron untuk membentuk ikatan koordinat sedangkan asam adalah zat yang dapat menerima sepasang elektron. Asam Lewis adalah zat yang bertindak sebagai akseptor elektron atau elektrofil sedangkan basa Lewis adalah
zat yang bertindak sebagai donor elektron atau nukleofil. Reaksi netralisasi menurut konsep Lewis melibatkan pembentukan ikatan koordinat.
Contoh sederhana dari konsep asam basa Lewis adalah reaksi antara proton dan ion hidroksil.
Pada reaksi di atas, OH- bertindak sebagai basa karena memberikan sepasang elektron kepada H+ yang digunakan untuk berikatan membentuk ikatan koordinat. Sedangkan H+ bertindak sebagai basa karena menerima sepasang elektron dari OH-.
Beberapa contoh reaksi yang lain:
Menurut konsep asam basa Lewis, spesi yang dapat bertindak sebagai asam Lewis yaitu:
(i) Molekul yang atom pusatnya memiliki oktet yang tidak lengkap : Asam Lewis adalah molekul kekurangan elektron seperti BF3, AICl3, GaCl3, dan lain-lain.
(ii) Molekul yang atom pusatnya memiliki orbital d kosong: Atom pusat senyawa halida seperti SiX4, GeX4, TiCl4, SnCl4, PX3, PF5, SF4, SeF4, TeCl4, memiliki orbital d kosong. Oleh karena itu, ini dapat menerima pasangan elektron dan bertindak sebagai asam Lewis.
(iii) Kation sederhana: Semua kation diharapkan bertindak sebagai asam Lewis karena sifatnya kekurangan elektron. Namun, kation seperti Na+, K+, Ca2+ (memiliki konfigurasi gas mulia) memiliki kecenderungan yang sangat kecil untuk menerima elektron, sedangkan kation seperti H+, Ag+, Fe3+, Cu2+, memiliki kecenderungan yang lebih besar untuk menerima elektron.
(iv) Molekul yang memiliki ikatan rangkap antara atom-atom dengan elektronegativitas yang berbeda : Contoh khas molekul yang termasuk dalam kelas asam Lewis ini adalah CO2, SO2 dan SO3. Ketika suatu basa Lewis menyerang molekul ini, satu pasangan elektron ϖ akan bergeser ke arah atom yang lebih negatif. Sehingga atom yang elektropositif akan kekurangan elektron dan dapat menerima sepasang elektron dari basa Lewis.
(v) Unsur-unsur dengan elektron valensi 6: Atom oksigen dan belerang mengandung enam elektron dalam kulit valensinya dan dapat menerima sepasang elektron tunggal dan bertindak sebagai asam Lewis.
Adapun spesi yang dapat bertindak sebagai basa Lewis yaitu:
(i) Molekul netral yang memiliki setidaknya satu pasang elektron tunggal: Misalnya, amonia, amina, dan alkohol, bertindak sebagai basa Lewis karena mengandung sepasang elektron.
(ii) Molekul bermuatan negatif atau anion sederhana : Misalnya, ion klorida, ion sianida, dan ion hidroksida, bertindak sebagai basa Lewis.
Perlu dicatat bahwa semua basa Bronsted-Lowry juga basa Lewis tetapi semua asam Lewis bukan asam Bronsted-Lowry.
Keterbatasan Konsep Asam Basa Lewis
(i) Teori Lewis gagal menjelaskan kekuatan relatif asam dan basa karena berbagai jenis reaksi terlibat.
(ii) Asam seperti HCl, H2SO4 tidak membentuk ikatan koordinat dengan basa.
Semua reaksi asam-basa cepat. Namun, terdapat beberapa pembentukan ikatan koordinat berjalan sangat lambat.














Konsep Arrhenius
BalasHapusAsam: Zat yang dalam air melepaskan ion hidrogen (H+).
Basa: Zat yang dalam air melepaskan ion hidroksida (OH-).
Keterbatasan: Hanya berlaku dalam larutan air, tidak mencakup semua jenis asam dan basa.
Konsep Brønsted-Lowry
Asam: Donor proton (H+).
Basa: Akseptor proton (H+).
Kelebihan: Lebih umum daripada Arrhenius, mencakup lebih banyak zat.
Keterbatasan: Tidak mencakup semua reaksi asam-basa, terutama yang tidak melibatkan transfer proton.
Konsep Lewis
Asam: Akseptor pasangan elektron.
Basa: Donor pasangan elektron.
Kelebihan: Paling umum, mencakup semua jenis reaksi asam-basa.
Keterbatasan: Kurang spesifik dalam menentukan kekuatan asam-basa.
Asam adalah senyawa yang mengandung satu atau lebih atom hidrogen dapat diganti sebagian atau seluruhnya oleh logam atau ion positif untuk menghasilkan garam. Beberapa teori (konsep) telah diusulkan untuk menjelaskan perilaku asam dan basa berdasarkan struktur dan komposisi, tetapi tidak ada teori tunggal yang menjelaskan perilaku asam dan basa secara keseluruhan. Masing-masing teori atau konsep dapat diterapkan dengan kelebihan dalam keadaan yang sesuai
BalasHapusKonsep Arrhenius:
Asam menghasilkan ion H⁺ dalam air.
Basa menghasilkan ion OH⁻ dalam air.
Reaksi netralisasi: H⁺ + OH⁻ → H₂O
Keterbatasan: Hanya berlaku untuk larutan berair, tidak menjelaskan sifat asam basa tanpa air, senyawa non-protik, dan beberapa garam.
Konsep Bronsted-Lowry:
Asam adalah donor proton (H⁺).
Basa adalah akseptor proton (H⁺).
Menjelaskan sifat asam basa dalam pelarut selain air.
Ada pasangan asam basa konjugasi.
Keterbatasan: Tidak bisa menjelaskan reaksi tanpa transfer proton.
Konsep Lewis:
Basa adalah donor pasangan elektron.
Asam adalah akseptor pasangan elektron.
Reaksi melibatkan pembentukan ikatan koordinat.
Lebih umum dari Bronsted-Lowry, mencakup reaksi tanpa transfer proton.
Contoh asam Lewis: BF₃, AlCl₃, kation (H⁺, Ag⁺, Fe³⁺), CO₂, SO₂.
Contoh basa Lewis: NH₃, amina, anion (Cl⁻, CN⁻, OH⁻).
Keterbatasan: Sulit menjelaskan kekuatan relatif asam basa, beberapa reaksi pembentukan ikatan koordinat berjalan lambat.
Perbandingan:
Semua basa Bronsted-Lowry adalah basa Lewis, tetapi tidak semua asam Lewis adalah asam Bronsted-Lowry.
Konsep Lewis adalah yang paling umum dan mendasar.
Berdasarkan materi tentang konsep asam-basa tersebut, kita dapat menyimpulkann bahwasahnya konsep asam basa ini pertama kali berkembang dari pernyataan Arrhenius yang membatasi definisi pada ion H⁺ (asam) dan OH⁻ (basa) dalam larutan berair, hingga pandangan Bronsted-Lowry yang lebih luas, menekankan transfer proton (H⁺) antara spesi kimia dalam berbagai pelarut, dengan asam sebagai pendonor proton dan basa sebagai penerima proton, serta memperkenalkan konsep pasangan asam-basa konjugat dan sifat amfoter. Konsep Lewis memperluas definisi lebih lanjut dengan fokus pada transfer pasangan elektron, di mana asam adalah akseptor pasangan elektron dan basa adalah donor pasangan elektron, mencakup reaksi yang tidak melibatkan transfer proton dan menjelaskan sifat asam basa senyawa yang tidak memiliki H atau OH, seperti BF₃ dan NH₃. Dengan demikian, teori Lewis merupakan definisi asam basa yang paling umum, meliputi kasus-kasus yang tidak dapat dijelaskan oleh teori Arrhenius maupun Bronsted-Lowry, meskipun memiliki keterbatasan dalam memprediksi kekuatan relatif asam basa dan beberapa reaksinya berjalan lambat.
BalasHapusTeori Arrhenius, Fokus pada larutan berair, mengidentifikasi asam sebagai donor ion H+ dan basa sebagai donor ion OH-. Keterbatasannya terletak pada ketidakmampuannya untuk menjelaskan asam-basa dalam pelarut non-air atau senyawa tanpa H+ atau OH-.
BalasHapusTeori Bronsted-Lowry, Memperluas konsep dengan mendefinisikan asam sebagai donor proton dan basa sebagai akseptor proton. Teori ini lebih fleksibel dan dapat menjelaskan reaksi asam-basa dalam berbagai pelarut.
Teori Lewis, Pendekatan paling umum, mendefinisikan asam sebagai akseptor pasangan elektron dan basa sebagai donor pasangan elektron. Teori ini mencakup reaksi yang tidak melibatkan transfer proton. Teori asam basa telah berkembang dari konsep sederhana (Arrhenius) menjadi konsep yang lebih luas dan umum (Lewis). Setiap teori memiliki kelebihan dan kekurangan, dan pemilihan teori yang tepat tergantung pada konteks reaksi yang sedang dipelajari. emilihan teori yang tepat tergantung pada konteks reaksi yang sedang dipelajari. Untuk reaksi sederhana dalam larutan air, teori Arrhenius mungkin sudah cukup. Namun, untuk reaksi yang lebih kompleks atau melibatkan pelarut non-air, teori Bronsted-Lowry atau Lewis lebih relevan.
Asam dan basa itu seperti dua sisi mata uang.
BalasHapusAsam itu kayak jeruk nipis, rasanya asem dan bisa bikin kulit kita jadi perih. Kalau dalam ilmu kimia, asam itu suka "memberikan" sesuatu yang disebut ion hidrogen.
Basa itu kayak sabun, rasanya pahit dan bisa bikin licin. Kalau dalam ilmu kimia, basa itu suka "menerima" ion hidrogen yang diberikan asam.
Ada banyak cara untuk melihat asam dan basa:
Arrhenius: Cara paling awal, yang bilang asam itu kalau dilarutkan dalam air jadi ion hidrogen, dan basa jadi ion hidroksida.
Bronsted-Lowry: Cara yang lebih umum, yang bilang asam itu yang suka memberi "proton" (ion hidrogen), dan basa yang suka menerima "proton".
Lewis: Cara yang paling luas, yang bilang asam itu yang suka "menerima" pasangan elektron, dan basa yang suka "memberikan" pasangan elektron.
Jadi, intinya: Asam dan basa itu penting banget dalam kimia. Mereka selalu berpasangan dan saling melengkapi. Sama seperti kita butuh teman yang berbeda-beda untuk membuat hidup kita lebih seru!
Mau tahu lebih banyak tentang asam dan basa? Kita bisa bahas tentang contoh-contoh asam dan basa dalam kehidupan sehari-hari, atau gimana caranya mengukur kekuatan asam dan basa.
Pilihan lain:
Asam dan basa di sekitar kita: Kita bisa cari tahu makanan apa saja yang mengandung asam atau basa. Misalnya, jeruk mengandung asam sitrat, sedangkan baking soda mengandung basa.
Asam dan basa dalam tubuh kita: Tubuh kita juga punya asam dan basa, lho! Misalnya, asam lambung membantu kita mencerna makanan, sedangkan darah kita harus punya pH (ukuran keasaman) yang stabil.
Konsep Arrhenius:
BalasHapus- Asam: Melepaskan ion H+ dalam air.
- Basa: Melepaskan ion OH- dalam air.
- Keterbatasan: Hanya berlaku di air dan tidak menjelaskan asam/basa dalam pelarut lain.
Konsep Bronsted-Lowry:
- Asam: Donor proton (H+).
- Basa: Penerima proton (H+).
- Kelebihan: Menjelaskan asam/basa dalam pelarut selain air.
- Keterbatasan: Tidak menjelaskan reaksi tanpa transfer proton.
Konsep Lewis:
- Asam Lewis: Penerima pasangan elektron.
- Basa Lewis: Penyumbang pasangan elektron.
- Kelebihan: Menjelaskan pembentukan ikatan koordinat.
- Keterbatasan: Tidak menjelaskan kekuatan relatif asam/basa.
Kesimpulannya, konsep asam basa mencakup teori Arrhenius, Bronsted-Lowry, dan Lewis, dengan masing-masing menjelaskan perilaku asam dan basa dalam konteks tertentu. Setiap teori memiliki kelebihan dan kekurangan, penerapannya bergantung pada kondisi reaksi dan pelarutan lingkungan.
BalasHapus- yang pertama, konsep Arrhenius. nah, di konsep ini, semua zat yang ada H+ nya kalau dilarutkan dalam air nanti dinamai asam dan yang terionisasi dalam air trus lepaskan ion OH- biasanya basa. Dalam konsep Arrhenius ada batasan atau kelemahannya, seperti hanya diterapkan untuk larutan berair, tidak bisa menjelaskan sifat asam dari non protik yang tidak bisa melepaskan ion H+, begitupun dengan yang tidak tidak bisa melepaskan ion OH-, serta sifat asam dari garam tertentu dalam larutan berair. Namun, kelemahan dari konsep ini dapat diperbaiki dengan cara menetralkan campuran yang ada. Dalam konsep ini juga, dibahas mengenai kebasaan suatu asam, keasaman suatu basa, serta kekuatan asam dan basa.
- Yang kedua, konsep Bronsted-Lowry. Nah konsep ini menjelaskan kalau asam spesies yang bisa seimbangkan proton dalam reaksi yang berarti donor proton/protogenik, dan basa itu spesies yang bisa menerima proton dalam reaksi yang berarti akseptor proton/protofilik. Kekuatan asam basa menurut konsep ini, kekuatan asam tergantung seberapa besar kehilangan protonnya, dan basa tergantung seberapa besar mendapatkan proton. Adapun keterbatasan konsep ini, tidak dapat diaplikasikan sebagai penjelasan rekasi yang terjadi pada pelarut yang tidak memiliki proton.
- Yang terakhir, konsep Asam Basa Lewis. Dalam konsep ini, menjelaskan bahwa basa zat yang memberikan sepasang electron yang membentuk ikatan koordinat, sedangkan asam zat yang menerima sepasang electron. Asam lewis adalah zat yang bertugas sebagai akseptor electron/elektrofil dan basa zat yang bertugas sebagai donor electron/nukleofil. Menurut konsep ini, reaksi netralisasi melibatkan pembentukan ikatan koordinat. Dalam konsep ini, dibahas spesi yang dapat bertindak sebagai asam lewis yaitu, melibatkan molekul dengan oktet tidak lengkap, orbital d kosong, kation sederhana, ikatan rangkap antara atom berbeda, dan unsur dengan enam elektron valensi, yang semuanya dapat menerima elektron atau pasangan elektron. Sedangkan basa lewis yaitu, molekul netral dengan setidaknya satu pasang elektron tunggal seperti amonia, amina, dan alkohol, serta molekul menghasilkan sinyal negatif atau anion sederhana seperti ion klorida, ion sianida, dan ion hidroksida, berfungsi sebagai basa Lewis. Adapun kelemahan dari konsep ini yaitu, tidak bisa menjelaskan kekuatan relative asam dan basa karena banyaknya jenis reaksi terlibat, dan beberapa asam tidak membentuk ikatan koordinat dengan basa.
Catatan bahwa semua basa Bronsted-Lowry juga basa Lewis tetapi semua asam Lewis bukan asam Bronsted-Lowry, serta semua reaksi asam basa cepat. Namun ada beberapa pembentukan ikatan koordinat berjalan sangat lambat.
Asam adalah senyawa yang mengandung satu atau lebih atom hydrogen dapat diganti Sebagian atau selurunya oleh logam atau ion positif untuk menghasilkan garams edangkan basa adalah senyawa yang cenderung menyumbangkan sepasang elektron untuk dipakai bersama sama dan menerima proton.Setelah mengetahui definisi dari asam dan basa ,ternyata terdapat juga beberapa ahli yang mengemukakan konsep mereka mengenai asam dan basa diantaranya ialah konsep Arrehenius,Bronsted-Lowry,dan Lewis.
BalasHapusKonsep Arrhenius
Konsep ini muncul pada tahun 1887.Menurut konsep ini,semua zat yang memberika n ion H+ ketika dilarutkan dalam air disebut asam sedangkan yang terionisasi dalam air melepaskan ion OH- disebut basa.Reaksi antara asam dan basa disebut reaksi netralisasi,dimana ion H+ dari asam dan ion OH- dari basa bereaksi membentuk air (H2 O}.Namun pada konsep Arrhenius terdapat pula keterbatasan yang dimiliki salah satu diantaranya ialah konsep Arrhenius berlaku untuk larutan berair.Dalam menentukan sifat basa dan asam keberadaan air sangat diperlukan,misalnya pada HCL murni {tidak mengandung air} tidak dapat bertindak sebagai asam karena HCL murni tidak dapat melepaskan ion H+ .Keterbatasan tersebut membuat konsep Arrhenius dimodifikasi,salah satu hasil modifikasi ialah air adalah elektrolit yang lemah dan terionisasi pada Tingkat yang sangat kecil.
Konsep Bronsted-Lowri
Konsep ini diusulkan pada tahun 1923.Menurut konsep ini,asam adalah spesies yang mampu menyumbangkan proton dalam reaksi sementara basa adalah spesies yang mampu menerima proton dalam reaksi.Asam disebut protogenik {donor proton} sedangkan basa disebut protofilik{akseptor proton}
Konsep Asam basa Lewis
Konsep ini dicetus pada tahu 1923.Menurut konsep ini,basa adalah zat yang dapat memberikan sepasang elektron basa adalah zat yang dapat memberikan sepasang elektron untuk membentuk ikatan koordinat sedangkan asam adalah zat yang dapat menerima sepasang elektron. Asam Lewis adalah zat yang bertindak sebagai akseptor elektron atau elektrofil sedangkan basa Lewis adalah zat yang bertindak sebagai donor elektron atau nukleofil. Reaksi netralisasi menurut konsep Lewis melibatkan pembentukan ikatan koordinat.
Konsep asam basa adalah salah satu konsep dasar dalam kimia yang menjelaskan sifat dan perilaku senyawa. Seiring perkembangan ilmu kimia, terdapat beberapa teori yang menjelaskan konsep ini, yaitu:
BalasHapus1. Teori Arrhenius
• Asam: Zat yang dalam air menghasilkan ion hidrogen (H+). Contoh: HCl, HNO₃.
• Basa: Zat yang dalam air menghasilkan ion hidroksida (OH-). Contoh: NaOH, KOH.
• Keterbatasan: Hanya berlaku dalam larutan air dan terbatas pada zat yang menghasilkan ion H+ atau OH-.
2. Teori Bronsted-Lowry
• Asam: Donor proton (H+).
• Basa: Akseptor proton (H+).
• Kelebihan: Lebih luas dari Arrhenius, berlaku untuk semua pelarut, tidak hanya air.
• Contoh: NH₃ (basa) menerima proton dari HCl (asam) membentuk NH₄+ dan Cl-.
3. Teori Lewis
• Asam: Akseptor pasangan elektron.
• Basa: Donor pasangan elektron.
• Kelebihan: Paling umum dan mencakup reaksi yang tidak melibatkan proton.
• Contoh: BF₃ (asam Lewis) menerima pasangan elektron bebas dari NH₃ (basa Lewis) membentuk BF₃NH₃.
Ketiga teori ini saling melengkapi, bukan saling bertentangan. Pemilihan teori yang tepat tergantung pada jenis reaksi dan zat yang terlibat.
Konsep asam basa sangat penting dalam berbagai bidang, mulai dari kimia organik dan anorganik hingga biokimia dan farmasi. Memahami ketiga teori ini akan membantumu lebih memahami reaksi-reaksi kimia yang terjadi di lingkungan sekitar.
Konsep Arrhenius:
BalasHapusa)Asam merupakan senyawa yang dapat menghasilkan ion H+ di dalam air. Misalnya: HCL (aq) = H+ (aq) + Cl- (aq).
b)Basa merupakan senyawa yang dapat menghasilkan ion OH- di dalam air. Misalnya:NaOH (aq) = Na+ (aq) + OH- (aq).
c)Reaksi netralisasi merupakan reaksi antara asam dan basa yang menghasilkan garam. Misalnya: NaOH (aq) + HCl (aq) = NaCl(aq) + H2O (l).
Keterbatasan dari teori ini adalah reaksi asam basa yang dijelaskan pada teori Arrhenius hanya terbatas pada larutan berair (aquaeus, aq) dan asam basa hanyakan zat yang menghasilkan ion H+ atau OH-.
Konsep Bronsted-Lowry:
a) Asam: senyawa yang dapat mendonorkan proton (H+) dapat berupa kation tau molekul netral.
b) Basa: senyawa yang dapat menerima proton (H+), dapat berupa anion atau molekul netral.
Menurut Bronsted-Lowry akan terjadi transfer proton dari asam ke basa, sehingga dikenal dengan istilah pasangan asam basa konjugasi. Bila asam mendonorkan protonnya, maka akan dihasilkan basa konjugasi, sedangkan basa yang menerima proton akan menghasilkan asam konjugasi.
Konsep Lewis:
a. Asam adalah senyawa yang dapat menerima pasangan elektron bebas dari zat/senyawa lain untuk membentuk ikatan baru.
b. Basa adalah senyawa yang dapat memberikan/mendonorkan pasangan elektron bebas dari zat/senyawa lain untuk membentuk ikatan baru.
Reaksi asam basa Lewis terjadi ketika terdapat senyawa basa yang mendonorkan pasangan elektronnya dan ada senyawa asam yang menerima pasangan elektron tersebut untuk membentuk ikatan baru. Produk yang terbentuk dari reaksi asam basa tersebut akan membentuk senyawa kompleks dan ikatan yang terjadi adalah ikatan kovalen koordinat.
konsep Arrhenius:
BalasHapus- Asam menghasilkan ion H+ dalam air.
- Basa menghasilkan ion OH- dalam air.
Dalam konsep ini, memiliki keterbatasan yaitu
1. terbatas di larutan air saja
2. tidak menjelaskan semua jenis reaksi asam basa
semakin banyak ion H+ yang dihasilkan oleh suatu asam, maka asam tersebut semakin kuat. Begitu pula, semakin banyak ion OH- yang dihasilkan oleh suatu basa, maka basa tersebut semakin kuat.
Intinya: Kekuatan asam atau basa menurut Arrhenius ditentukan oleh seberapa mudah zat tersebut melepaskan ion-ionnya dalam larutan.
Konsep Bronsted-Lowry:
Asam: Memberikan proton (H+) dalam reaksi kimia.
Basa: Menerima proton (H+) dalam reaksi kimia.
Keunggulan dari konsep asam basa Bronsted-Lowry yaitu dapat menjelaskan sifat asam basa pada pelarut lain selain air, yang memiliki kecenderungan untuk menerima atau kehilangan proton.
Konsep asam basa Brønsted-Lowry memiliki keterbatasan. Konsep ini berfokus pada transfer proton (ion H+). Jika suatu zat memberikan proton pada zat lain, maka zat pertama adalah asam, dan zat kedua adalah basa. Namun, konsep ini tidak berlaku untuk semua jenis reaksi asam-basa dan pelarut tanpa proton
Konsep Asam Basa Lewis:
Basa Lewis: Memberikan pasangan elektron.
Asam Lewis: Menerima pasangan elektron.
namun, semua basa Bronsted-Lowry juga basa Lewis tetapi semua asam Lewis bukan asam Bronsted-Lowry.
Teori ini punya kelemahan yaitu
- Teori Lewis gagal menjelaskan kekuatan relatif asam dan basa karena berbagai jenis reaksi terlibat.
- ada asam yang tidak bisa membentuk ikatan hidrogen dengan basa
Teori Arrhenius
BalasHapusDefinisi: Asam adalah zat yang terdisosiasi dalam air untuk menghasilkan ion hidrogen (H+), sedangkan basa menghasilkan ion hidroksida (OH-).
Keterbatasan: Terbatas pada larutan berair, tidak dapat menjelaskan sifat asam atau basa zat dalam pelarut non-air, dan tidak dapat menjelaskan asam tanpa hidrogen atau basa tanpa hidroksida.
Teori Bronsted-Lowry
Definisi: Asam adalah donor proton, sedangkan basa adalah akseptor proton. Kelebihan: Memperluas konsep asam dan basa di luar larutan berair.
Keterbatasan: Tidak dapat menjelaskan reaksi tanpa transfer proton.
Teori Lewis
Definisi: Asam adalah akseptor pasangan elektron, sedangkan basa adalah donor pasangan elektron.
Kelebihan: Teori yang paling komprehensif, karena mencakup semua reaksi asam-basa.
Keterbatasan: Tidak menjelaskan kekuatan relatif asam dan basa.
Pasangan asam-basa konjugat: Ketika asam kehilangan proton, spesies yang tersisa adalah basa konjugatnya, dan sebaliknya.
Zat amfoterik: Dapat bertindak sebagai asam dan basa, seperti air.
Kekuatan asam-basa: Diukur dengan konstanta kesetimbangan (Ka atau Kb).
Keterbatasan setiap teori: Setiap teori memiliki cakupan dan keterbatasannya sendiri, dan tidak ada yang berlaku secara universal.
Jadi teori Arrhenius memberikan pemahaman dasar tentang asam dan basa dalam larutan berair, teori Bronsted-Lowry menawarkan perspektif yang lebih luas. Akan tetapi, teori Lewis memberikan definisi yang paling umum, yang mencakup semua reaksi asam-basa.
Konsep Asam Basa : Konsep Arrhenius yang dipublikasikan pada tahun 1887 berpendapat bahwa semua zat yang memberikan ion H+ ketika dilarutkan dalam air disebut asam sedangkan akan menjadi basa jika terionisasi dalam air melepaska ion H-. Reaksi antara asam basa disebut netralisasi. Tetapi memiliki keterbatasan antara lain hanya berlaku untuk larutan berair, tidak menjelaskan sifat asam basa dalam pelarut, gagal menjelaskan sifat dasar senyawa, dan gagal menjelaskan sifat asam garam tertentu dalam larutan berair. Kebanyakan dari keterbatasan ini dengan konsep Arrhenius dapat dimodifikasi dengan meningkatkan konsentrasi salah satu ion asam basa. Kebebasan suatu asam adalah jumlah hidrogen yang dapat disediakan oleh satu molekul asam pada saat disosiasi. Keasaman suatu basa jika jumlah ion hidroksil yang dihasilkan dari satu molekul basa pada disosiasi. Kekuatan asam dan basa berdasar pada jumlah ion hidroksil yang dihasikan dari satu molekul basa pada disosiasi. Kekuatan asam dan basa berdasarkan tingkat ionisasi atau konstanta.
BalasHapusKonsep Bronsted Lowry (1923) menyatakan asam adalah spesies yang mampu menyumbangkan proton dalam reaksi sementarabasa adalah spesies yang mampu menerima proton dalam reaksi yaitu asam adalah donor proton dan basa adalah akseptor proton protofilik. Kekuatan asam dan basa tergntung pada kecenderungannya untuk kehilangan protonnya dan kekuatan basa tergantug pada kecenderungan untuk mendapatkan proton. Keterbatasan konsep ini adalah tidak dapat digunakan untuk menjelaskan reaksi pelarut tanpa proton.
Konsep Asam Basa lewais (1923) menyatakan bahwa basa adalah zat yang dapat memberikan sepasang elektron untuk membentuk ikatan koordinat sedangkan asam adalah zat yang dapat menerima sepasang elektron. Ada beberapa kriteria spesies yang bertindak seperti asma Lewis begitupun juga dengan basa Lewis. Keterbatasan konsep ini adalah gagal menjelaskan kekuatan relatif dan tidak membentukn ikatan koordinat dengan basa pada beberapa asam.
Asam adalah senyawa yang mengandung satu atau lebih atom hidrogen. Terdapat beberapa teori (konsep) yang telah diusulkan untuk menjelaskan perilaku asam & basa berdasarkan struktur dan komposisinya. Namun tidak ada teori tunggal yang menjelaskan perilaku asal dan basa secara keseluruhan. Konsep yang digunakan oleh ahli kimia adalah konsep yang sering sesuai dengan situasinya.
BalasHapus1. Konsep arrhenius, muncul pada tahun 1887. menurut konsep ini semua zat yang memberikan ion H+ ketika dilarutkan dalam air disebut asam sementara yang terionisasi dalam air melepaskan ion H- disebut basa
Namun konsep arrhenius juga memiliki keterbatasan diantaranya Konsep Arrhenius tidak menjelaskan sifat asam atau basa dalam pelarut bukan air, konsep arrhenius juga gagal menjelaskan sifat asam dari garam-garam tertentu seperti sebagai AICl3 dalam larutan berair.
2. Konsep Bronsted-Lowry
Konsep ini diusulkan pada tahun 1923. Menurut konsep ini, asam adalah spesies yang mampu menyumbangkan proton dalam reaksi sementara basa adalah spesies yang mampu menerima proton dalam reaksi, yaitu asam adalah donor proton (protogenik) dan basa adalah akseptor proton (protofilik). Keunggulan dari konsep asam basa Bronsted-Lowry yaitu dapat menjelaskan sifat asam basa pada pelarut lain selain air, yang memiliki kecenderungan untuk menerima atau kehilangan proton. Keterbatasan Konsep Asam Basa Brosnted-Lowry
Suatu zat disebut sebagai asam atau basa jika bereaksi dengan zat lain. Jika menyumbangkan proton ke zat lain, maka zat itu adalah asam dan jika menerima proton dari zat lain, zat itu adalah basa
3. Konsep Asam Basa Lewis
Konsep tentang sifat asam-basa yang pada tahun 1923. Menurut konsep ini, basa adalah zat yang dapat memberikan sepasang elektron untuk membentuk ikatan koordinat sedangkan asam adalah zat yang dapat menerima sepasang elektron. Asam Lewis adalah zat yang bertindak sebagai akseptor elektron atau elektrofil sedangkan basa Lewis adalah zat yang bertindak sebagai donor elektron atau nukleofil. Reaksi netralisasi menurut konsep Lewis melibatkan pembentukan ikatan koordinat.
Menurut konsep asam basa Lewis, spesi yang dapat bertindak sebagai asam Lewis yaitu:
(i) Molekul yang atom pusatnya memiliki oktet yang tidak lengkap
(ii) Molekul yang atom pusatnya memiliki orbital
(iii) Kation sederhana
(iv) Molekul yang memiliki ikatan rangkap antara atom-atom dengan elektronegativitas yang berbeda
(v) Unsur-unsur dengan elektron valensi 6
Adapun spesi yang dapat bertindak sebagai basa Lewis yaitu:
(i) Molekul netral yang memiliki setidaknya satu pasang elektron tunggal: Misalnya, amonia, amina, dan alkohol, bertindak sebagai basa Lewis karena mengandung sepasang elektron.
(ii) Molekul bermuatan negatif atau anion sederhana : Misalnya, ion klorida, ion sianida, dan ion hidroksida, bertindak sebagai basa Lewis.
Keterbatasan Konsep Asam Basa Lewis
(i) Teori Lewis gagal menjelaskan kekuatan relatif asam dan basa karena berbagai jenis reaksi terlibat.
(ii) Asam seperti HCl, H2SO4 tidak membentuk ikatan koordinat dengan basa.
ANNISA NADHIRAH RAMADANI
BalasHapusTeori asam basa merupakan konsep fundamental dalam kimia yang digunakan untuk
menjelaskan sifat dan reaksi senyawa. Terdapat tiga teori utama, yaitu Arrhenius, Brønsted-
Lowry, dan Lewis.
1. Teori Asam Basa Arrhenius
Teori ini yang paling sederhana, mendefinisikan asam sebagai zat yang dalam air
menghasilkan ion hidronium (H₃O⁺), sedangkan basa menghasilkan ion hidroksida (OH⁻).
Contoh: HCl (asam klorida) dalam air akan terionisasi menjadi H⁺ dan Cl⁻. Ion H⁺ akan
berikatan dengan molekul air membentuk H₃O⁺. NaOH (natrium hidroksida) dalam air
akan terionisasi menjadi Na⁺ dan OH⁻.
Teori ini hanya berlaku dalam larutan air dan tidak dapat menjelaskan semua jenis asam dan
basa. Misalnya, amonia (NH₃) bersifat basa namun tidak menghasilkan ion OH⁻ secara
langsung dalam air.
2. Teori Asam Basa Brønsted-Lowry
Teori ini lebih luas, mendefinisikan asam sebagai donor proton (H⁺) dan basa sebagai
akseptor proton.
Contoh: HCl (asam) mendonorkan proton kepada H₂O (basa), membentuk H₃O⁺ dan
Cl⁻. NH₃ (basa) menerima proton dari H₂O (asam), membentuk NH₄⁺ dan OH⁻.
Teori ini dapat menjelaskan lebih banyak reaksi asam-basa dibandingkan teori Arrhenius,
termasuk reaksi yang tidak melibatkan air. Akan tetapi, teori ini masih terbatas pada reaksi
yang melibatkan transfer proton.
3. Teori Asam Basa Lewis
Teori ini yang paling umum, mendefinisikan asam sebagai penerima pasangan elektron dan
basa sebagai donor pasangan elektron.
Contoh: BF₃ (asam Lewis) menerima pasangan elektron bebas dari NH₃ (basa Lewis)
membentuk BF₃NH₃.
Teori ini sangat luas dan dapat menjelaskan berbagai reaksi kimia, termasuk reaksi yang tidak
melibatkan proton. Akan tetapi, karena teori ini sangat umum sehingga kadang sulit untuk
mengidentifikasi asam dan basa dalam beberapa reaksi.
Kesimpulan dari teks di atas adalah konsep Arrhenius (1887) memberikan konsep bahwa zat yang memberikan ion H+ Ketika dilarutkan dalam air disebut asam, dan yang terionisasi dalam air melepaskan ion OH- disebut basa. Keterbatasan konsep ini ialah konsep ini hanya berlaku untuk larutan berair sehingga tidak bisa menjelaskan sifat asam basa pada pelarut bukan air, tidak bisa menjelaskan senyawa asam dari senyawa non-protik yang tidak punya hydrogen untuk melepaskan ion H+, tidak bisa menjelaskan sifat dasar senyawa seperti NH3 dan Na2CO3 yangg tidak punya OH untuk melepaskan ion OH-, serta tidak bisa menjelaskan sifat asam dari garam tertentu seperti AlCl3 dalam larutan berair. Konsep ini dimodifikasi sehingga memperbaiki sebagian besar keterbatasannya.
BalasHapusKonsep bronsted-lowry (1923) memberikan konsep bahwa asam adalah spesies yang mampu memberikan proton dalam reaksi (protogenik) sedangkan basa adalah spesies yang menerima proton dalam reaksi (protofolik). Keunggulan dari konsep ini ialah dapat menjelaskan sifat asam basa pada pelarut selain air, dan menentukan perilaku asam atau basa dari zat terlarut dalam pelarut. Keterbatasan dari konsep ini ialah tidak dapat menjelaskan raksi-reaksi yang terjadi pada pelarut yang tidak memiliki proton.
Konsep asam basa lewis (1923) lebih umum dan mendasar dibandingkan dengan konsep yang lain. Berdasarkan konsep ini, basa ialah zat yang dapat memberikan sepasang electron untuk membentuk ikatan koordinat (donor electron/nukleofil) sedangkan asam ialah zat yang dapat menerima sepasang electron (akseptor electron/elektrofil). Keterbatasan konsep ini ialah gagal menjelaskan kekuatan relative asam basa karena berbagai jenis reaksi terlibat, serta ada beberapa asam yang tidak membentuk ilatan koordinat dengan basa seperti HCL dan H2SO4
- Sitti Althafunnisa
Dari pembahasan materi di atas dapat disimpulkan bahwa konsep asam basa memiliki beberapa teori atau konsep dan keterbatasan diantaranya :
BalasHapusKonsep Arrhenius
Semua zat yang memberikan ion H+ ketika dilarutkan dalam air disebut asam sedangkan yang terionisasi dalam air melepaskan ion OH- disebut basa. Contohnya Reaksi antara asam dan basa disebut reaksi netralisasi, dimana ion H+ dari asam dan ion OH- dari basa bereaksi membentuk air (H2O). OH- + H+ ⇌ H2O. Konsep ini memiliki keterbatasan salah satunya ialah konsep ini tidak menjelaskan sifat asam atau basa dalam pelarut bukan air.
Konsep Bronsted-Lowry
Asam adalah spesies yang mampu menyumbangkan proton dalam reaksi sementara basa adalah spesies yang mampu menerima proton dalam reaksi, yaitu asam adalah donor proton (protogenik) dan basa adalah akseptor proton (protofilik). Contohnya reaksi antara HCl + H2O ⇌H3O+ + Cl-. Dimana dalam reaksi ini, HCl bertindak sebagai asam karena menyumbangkan proton (H+) ke molekul air. Di sisi lain, air berperilaku sebagai basa dengan menerima proton (H+) dari asam. Keterbatasan dari konsep ini yakni tidak dapat digunakan untuk menjelaskan reaksi-reaksi yang terjadi pada pelarut yang tidak memiliki proton.
Konsep Asam Basa Lewis
Basa adalah zat yang dapat memberikan sepasang elektron untuk membentuk ikatan koordinat sedangkan asam adalah zat yang dapat menerima sepasang elektron. Contoh sederhana dari konsep asam basa Lewis adalah reaksi antara proton dan ion hidroksil. Keterbatasan dari konsep ini salah satunya ialah Teori Lewis ini gagal menjelaskan kekuatan relatif asam dan basa karena berbagai jenis reaksi terlibat.
=Konsep Arrhenius
BalasHapus-Asam: Suatu zat yang jika dilarutkan dalam air akan menghasilkan ion hidrogen (H+).
-Basa: Suatu zat yang jika dilarutkan dalam air akan menghasilkan ion hidroksida (OH-)
~Kebasaan Suatu Asam dan Keasaman Suatu Basa
-Kebasaan suatu asam: Semakin banyak ion H+ yang dilepaskan oleh suatu asam dalam larutan, maka semakin kuat asam tersebut.
-Keasaman suatu basa: Semakin banyak ion OH- yang dilepaskan oleh suatu basa dalam larutan, maka semakin kuat basa tersebut.
~Kekuatan asam dan basa dapat diukur menggunakan skala pH.
=Konsep Bronsted-Lowry
Teori ini mendefinisikan asam sebagai zat yang dapat memberikan proton (H+) dan basa sebagai zat yang dapat menerima proton.
~Kekuatan Asam dan Basa
-Kekuatan asam: Semakin mudah suatu zat melepaskan proton, maka semakin kuat asamnya.
-Kekuatan basa: Semakin mudah suatu zat menerima proton, maka semakin kuat basanya.
=Konsep Lewis
-Asam lewis: adalat suatu zat yang dapat menerima pasangan elektron. Dengan kata lain, asam lewis adalah akseptor pasangan elektron.
-Basa lewis: adalah suatu zat yang dapat memberikan pasangan elektron. Dengan kata lain, basa lewis adalah donor pasangan elektron.
Berdasarkan paparan diatas kita dapat mengtahui bahwa:
BalasHapus1. Menurut arhenius,
semua zat yang memberikan ion H+ ketika dilarutkan dalam air sehingga bergabung dengan molekul pelarut disebut asam sedangkan yang terionisasi dalam air melepaskani ion OH- disebut basa. Reaksi antara asam dan basa disebut reaksi netralisasi, dimana ion H+ dari asam dan ion OH- dari basa bereaksi membentuk air (H2O).
Dari konsep yang dikemukakan oleh arrhenius tersebut, terdapat beberapa kekurangan yang dimodifikasi seperti Konsep yang gagal menjelaskan sifat asam dari senyawa non-protik (tidak memiliki proton) seperti SO2 yang tidak memiliki hidrogen untuk melepaskan ion H+. kekurangan tersebut dapat di sanggah yaitu dengan cara O2 meningkatkan konsentrasi ion H3O+ dalam air, oleh karena itu, SO2 bersifat asam.
Kekuatan asam atau basa dalam konsep Arrhenius adalah bahwa Nilai Ka/Kb (kekuatan asam/kekuatan basa) untuk alkali kuat yang lebih tinggi dari 0.1 merupakan standar basa yang kuat. Dan sebaliknya untuk basa lemah memiliki nilai Kb rendah.
2. Menurut Bronsted-Lowry asam adalah spesies yang mampu menyumbangkan proton dalam reaksi sementara basa adalah spesies yang mampu menerima proton dalam reaksi, yaitu asam adalah donor proton (protogenik) dan basa adalah akseptor proton (protofilik).
Menurut Bronsted-Lowry Kekuatan asam tergantung pada kecenderungannya untuk kehilangan protonnya dan kekuatan basa tergantung pada kecenderungannya untuk mendapatkan proton. Di samping itu, teori yang di buat oleh Bronsted-Lowry memiliki kekurangan yang dapat membantah teori mengenai umpan balik yang diberikan oleh masing masing zat yang memberi dan menerima. Bahwasanya ada sejumlah reaksi asam-basa di mana tidak ada transfer proton yang terjadi.
3. Menurut Lewis, basa adalah zat yang dapat memberikan sepasang elektron untuk membentuk ikatan koordinat sedangkan asam adalah zat yang dapat menerima sepasang elektron.
Menurut konsep asam basa Lewis, spesi yang dapat bertindak sebagai asam Lewis yaitu:
• Molekul yang atom pusatnya memiliki oktet yang tidak lengkap
Molekul yang atom pusatnya memiliki orbital d kosong
• Semua kation diharapkan bertindak sebagai asam Lewis karena sifatnya kekurangan elektron.
• Molekul yang memiliki ikatan rangkap antara atom-atom dengan elektronegativitas yang berbeda
• Unsur-unsur dengan elektron valensi 6
Adapun spesi yang dapat bertindak sebagai basa Lewis yaitu:
• Molekul netral yang memiliki setidaknya satu pasang elektron tunggal
• Molekul bermuatan negatif atau anion sederhana
Keterbatasan Konsep Asam Basa Lewis
• Teori Lewis gagal menjelaskan kekuatan relatif asam dan basa karena berbagai jenis reaksi terlibat.
• Asam seperti HCl, H2SO4 tidak membentuk ikatan koordinat dengan basa.
• Semua reaksi asam-basa cepat. Namun, terdapat beberapa pembentukan ikatan koordinat berjalan sangat lambat.
Catatan: kita dapat menyimpulkann bahwasahnya konsep asam basa teori Lewis merupakan definisi asam basa yang paling umum, meliputi kasus-kasus yang tidak dapat dijelaskan oleh teori Arrhenius maupun Bronsted-Lowry, meskipun memiliki keterbatasan dalam memprediksi kekuatan relatif asam basa dan beberapa reaksinya berjalan lambat.
Terdapat 3 teori atau konsep mengenai Asam Basa yang paling popular, diantaranya:
BalasHapus1. Konsep Arrhenius
Asam adalah Semua zat yang memberikan ion H⁺ ketika dilarutkan dalam air.
Basa adalah Semua zat yang terionisasi dalam air melepaskan ion OH⁻.
Keterbatasan Konsep Arrhenius ialah Hanya berfokus keadaan senyawa pada pelarut air saja, selain itu juga konsep Arrhenius membedakan senyawa yang bersifat Asam dan Basa dari molekul yang melepaskan ion H⁺ dan ion OH⁻ saja, sehingga konsep Arrhineus tidak dapat menjelaskan sifat asam atau basa dari senyawa-senyawa yang tidak memiliki OH dan senyawa non-protik .
2. Konsep Bronsted-Lowry
Asam adalah spesies yang dapat menyumbang proton dalam reaksi.
Basa adalah spesies yang dapat menerima proton dalam reaksi.
Keterbatasan Konsep Bronsted-Lowry ialah konsep ini membedakan suatu senyawa bersifat asam atau basa jika bereaksi dengan senyawa lain yang kemudian melihat senyawa yang menerima ataupun melepaskan proton, konsep ini tidak dapat digunakan dalam reaksi asam-basa yang didalam reaksinya tidak terjadi transfer proton.
3. Konsep Lewis
Asam adalah zat yang menerima sepasang elektrok untuk membentuk ikatan koordinat.
Basa adalah zat yang melepas sepasang elektron untuk membentuk ikatan koordinat.
Keterbatasan Konsep Lewis ialah tidak menjelaskan kekuatan relative asam dan basa karena melibatkan berbagai jenis reaksi terlibat, selain itu beberapa asam tidak membentuk ikatan koordinat dengan basa, juga reaksi asam basa ada yang cepat namun juga ada yang sangat lama.
Sehingga, dapat disimpulkan bahwa setiap konsep asam basa memiliki cara membedakan senyawa asam dan basa masing-masing, juga memiliki keterbatasannya masing-masing.
TEORI KONSEP ASAM BASA
BalasHapusA. Konsep Arrhenius (1887)
• Asam : Zat yang melepaskan ion H+ dalam air.
• Basa : Zat yang melepaskan ion OH- dalam air.
• Kelebihan : Sederhana, mudah dipahami, sesuai untuk reaksi yang terjadi di larutan berair
• Keterbatasan : Tidak berlaku untuk pelarut non-air, tidak menjelaskan reaksi yang tidak melibatkan ion H+ atau OH-
B. Konsep Bronsted-Lowry (1923)
• Asam : Donor proton (H+)
• Basa : Akseptor proton (H⁺)
• Kelebihan : Lebih luas dari teori Arrhenius, tidak terbatas pada larutan berair
• Keterbatasan : Masih membutuhkan keberadaan proton untuk mendefinisikan reaksi asam-basa
C. Konsep Asam Basa Lewis
• Asam : Akseptor pasangan elektron
• Basa : Donor pasangan elektron
• Kelebihan : Konsep paling umum yang mencangkup reaksi tanpa proton, mampu menjelaskan lebih banyak reaksi kimia
• Keterbatasan : Lebih kompleks dalam penerapannya, membutuhkan pengetahuan tentang struktur elektron senyawa