Secara umum, ketika reaksi dilakukan di laboratorium kita tidak benar-benar memperoleh hasil teoritis dari produk. Jumlah produk yang sebenarnya diperoleh disebut hasil aktual. Dengan mengetahui hasil aktual dan hasil teoretis, kita dapat menentukan persen hasil dengan rumus berikut:
Contoh Soal 1:
Sebanyak 7,8 gram sampel C6H6 bereaksi dengan HNO3 berlebih menghasilkan 9,0 gram C6H5NO2. Tentukan persen hasil C6H5NO2 pada eksperimen tersebut!
Jawaban:
Persamaan reaksi setara dari reaksi C6H6 dengan HNO3 yaitu:
C6H6 + HNO3 → C6H5NO2 + H2O
Massa molekul relatif senyawa:
Mr C6H6 = (6 x Ar C) + (6 x Ar H) = (6 x 12 gram/mol) + (6 x 1 gram/mol) = 78 gram/mol
Mr C6H5NO2 = (6 x Ar C) + (5 x Ar H) + (1 x Ar N) + (2 x Ar O) = (6 x 12 gram/mol) + (5 x 1 gram/mol) + (1 x 14 gram/mol) + (2 x 16 gram/mol) = 123 gram/mol
Hitung mol dari pereaksi yang diketahui massanya yaitu C6H6 :
Mol C6H6 = massa/Mr = 7,8 gram / 78 gram/mol = 0,1 mol
Dari reaksi di atas, berdasarkan koefisien reaksi ditunjukkan bahwa 1 mol C6H6 akan bereaksi sempurna dengan HNO3 menghasilkan 1 mol C6H5NO2.
Mol C6H5NO2 = (koefisien C6H5NO2. / koefisien C6H6) x mol C6H6 = (1/1) x 0,1 mol = 0,1 mol
Jadi, secara teoritis massa C6H5NO2 yang dihasilkan = mol x Mr = 0,1 mol x 123 gram/mol = 12,3 gram
Hasil aktual C6H5NO2 yang dihasilkan adalah 9,0 gram, maka:
%hasil C6H5NO2 = (9,0 gram / 12,3 gram) x 100% = 73,17%
Contoh Soal 2:
Jika 4,8 gram N2F4 dihasilkan ketika 4,0 gram NH3 bereaksi dengan 14,0 gram F2 sesuai reaksi:
2NH3 + 5F2 → N2F4 + 6HF
Tentukan persen hasil N2F4!
Jawaban:
Persamaan reaksi setara:
2NH3 + 5F2 → N2F4 + 6HF
Massa molekul relatif senyawa:
Mr NH3 = (1 x Ar N + (3 x Ar H) = (1 x 14 gram/mol) + (3 x 1 gram/mol) = 17 gram/mol
Mr F2 = (2 x Ar F) = (2 x 19 gram/mol) = 38 gram/mol
Mr N2F4 = (2 x Ar N + (4 x Ar F) = (2 x 14 gram/mol) + (4 x 19 gram/mol) = 104 gram/mol
Hitung mol dari kedua pereaksi yang diketahui massanya :
Mol NH3 = massa/Mr = 4 gram / 17 gram/mol = 0,2353 mol
Mol F2 = massa/Mr = 14 gram / 38 gram/mol = 0,3589 mol
Untuk mengetahui zat yang menjadi pereaksi pembatas dan zat yang berlebih, kita harus menguji masing-masing pereaksi dan menganggap salah satu pereaksi sebagai pereaksi pembatas.
Jika NH3 adalah pereaksi pembatas, maka jumlah mol F2 yang bereaksi adalah:
Mol F2 = (koefisien F2 / koefisien NH3) x mol NH3 = (5/2) x 0,2353 mol = 0,58825 mol
Jika F2 adalah pereaksi pembatas, maka jumlah mol NH3 yang bereaksi adalah:
Mol NH3 = (koefisien NH3 / koefisien F2) x mol F2 = (2/5) x 0,3589 mol = 0,14356 mol
Perhitungan di atas memperlihatkan bahwa jika NH3 menjadi pereaksi pembatas maka F2 yang bereaksi sebanyak 0,58825 mol, sementara mol F2 yang tersedia adalah 0,3589 mol. Maka hal ini tidak mungkin terjadi. Sehingga zat yang paling mungkin menjadi pereaksi pembatas adalah F2.
Mol F2 menjadi acuan jumlah mol N2F4 yang terbentuk:
Mol N2F4 = (koefisien N2F4 / koefisien F2) x mol F2 = (1/5) x 0,3589 mol = 0,07178 mol
Jadi, secara teoritis massa N2F4 yang dihasilkan = mol x Mr = 0,07178 mol x 104 gram/mol = 7,46512 gram
Hasil aktual C6H5NO2 yang dihasilkan adalah 4,8 gram, maka:
%hasil N2F4 = (4,8 gram / 7,46512 gram) x 100% = 64,299%
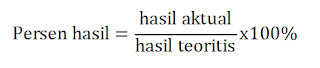


Tidak ada komentar:
Posting Komentar