Laju reaksi rata-rata
Untuk reaksi A + B → C laju reaksinya adalah
Δ didefinisikan sebagai kondisi akhir dikurangi kondisi awal (selisih/perubahan) sehingga laju reaksinya
Laju reaksi sesaat
Untuk reaksi A + B → C laju reaksinya adalah
Lajunya hanya bergantung pada konsentrasi reaktan (A dan B). m dan n merupakan orde reaksi yang dapat ditentukan melalui percobaan.
Penentuan Laju Rata-rata
Contoh:
Berikut adalah grafik perubahan konsentrasi B terhadap waktu. Berapakah laju pengurangan B antara 10 hingga 40 detik?

Jawab:
r = 0,006 M/s
Penetuan Laju Sesaat
Untuk reaksi A + B → C laju reaksinya adalah
r = k [A]m [B]n
Contoh:
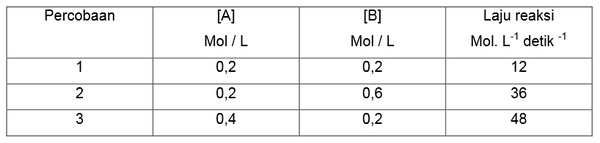
Tentukan masing-masing orde reaksi A dan B berdasarkan data percobaan sebagai berikut.
2A (g) + B (g) → 2AB
2A (g) + B (g) → 2AB

Penyelesaian
v = k [A]x [B]y
Langkah-langkah penentuan orde reaksi yaitu sebagai berikut.
1.Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama
a. Untuk mencari orde reaksi A maka perhatikan [ B ] yang sama : Percobaan 1 dan 3
b. Untuk mencari orde reaksi B maka perhatikan [ A ] yang sama : Percobaan 1 dan 2
2.Bandingkan 2 data percobaan tersebut dengan memasukkannya kedalam persamaan umum laju reaksi. Percobaan 1 dan 3
v = k [A]x [B]y
Langkah-langkah penentuan orde reaksi yaitu sebagai berikut.
1.Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama
a. Untuk mencari orde reaksi A maka perhatikan [ B ] yang sama : Percobaan 1 dan 3
b. Untuk mencari orde reaksi B maka perhatikan [ A ] yang sama : Percobaan 1 dan 2
2.Bandingkan 2 data percobaan tersebut dengan memasukkannya kedalam persamaan umum laju reaksi. Percobaan 1 dan 3





Tidak ada komentar:
Posting Komentar