Asam basa
adalah dua kelompok zat kimia yang memiliki sifat berlawanan. Asam adalah zat
yang dapat memberikan ion hidrogen (H+) atau proton kepada zat lain.
Basa adalah zat yang dapat menerima ion hidrogen (H+) atau proton
dari zat lain. Asam dan basa dapat bereaksi satu sama lain dalam suatu proses
yang disebut reaksi asam-basa.
Dalam
artikel ini, Anda akan mempelajari pengertian asam basa, sifat asam basa,
contoh asam basa, dan cara mengenali asam basa. Artikel ini akan membantu Anda
memahami konsep asam basa dengan mudah dan menyenangkan.
Apa itu Asam Basa?
Asam basa
adalah dua kelompok zat kimia yang memiliki sifat berlawanan. Asam adalah zat
yang dapat memberikan ion hidrogen (H+) atau proton kepada zat lain.
Basa adalah zat yang dapat menerima ion hidrogen (H+) atau proton
dari zat lain.
Ion
hidrogen (H+) atau proton adalah partikel bermuatan positif yang
terdapat dalam atom hidrogen. Ion hidrogen dapat berpindah dari satu zat ke zat
lain melalui ikatan kovalen atau ikatan ion.
Asam dan
basa dapat bereaksi satu sama lain dalam suatu proses yang disebut reaksi
asam-basa. Reaksi asam-basa adalah reaksi yang terjadi antara asam dan basa
yang menghasilkan garam dan air.
Garam
adalah senyawa ionik yang terbentuk dari kation (ion positif) dari basa dan
anion (ion negatif) dari asam. Air adalah senyawa kovalen yang terbentuk dari
ion hidrogen dari asam dan ion hidroksida (OH-) dari basa.
Reaksi
asam-basa dapat ditulis dalam bentuk persamaan kimia sebagai berikut:
Asam + Basa
→ Garam + Air
Contoh
reaksi asam-basa adalah sebagai berikut:
HCl + NaOH →
NaCl + H2O
Asam
klorida + Natrium hidroksida → Natrium klorida + Air
Bagaimana Sifat Asam dan Basa?
Asam dan
basa memiliki beberapa sifat khas yang dapat digunakan untuk mengenali dan
membedakannya. Berikut adalah beberapa sifat asam dan basa:
- Asam
memiliki rasa asam, sedangkan basa memiliki rasa pahit.
- Asam
dapat merubah warna indikator asam-basa menjadi merah, sedangkan basa dapat
merubah warna indikator asam-basa menjadi biru.
- Indikator
asam-basa adalah zat yang dapat berubah warna sesuai dengan tingkat keasaman
atau kebasaan suatu larutan. Contoh indikator asam-basa adalah kertas lakmus,
fenolftalein, atau kunyit.
- Kertas
lakmus berwarna merah jika dicelupkan ke dalam larutan asam dan berwarna biru
jika dicelupkan ke dalam larutan basa. Fenolftalein berwarna tak berwarna jika
dicelupkan ke dalam larutan asam dan berwarna merah muda jika dicelupkan ke
dalam larutan basa. Kunyit berwarna kuning jika dicelupkan ke dalam larutan
asam dan berwarna merah jika dicelupkan ke dalam larutan basa.
Gambar : Indikator asam-basa
- Asam
dapat menghantarkan arus listrik dalam larutan, sedangkan basa juga dapat
menghantarkan arus listrik dalam larutan.
- Arus
listrik adalah aliran muatan listrik dalam suatu media. Muatan listrik dalam
larutan asam atau basa berasal dari ion-ion yang terlarut di dalamnya.
- Asam
bereaksi dengan logam aktif seperti seng, besi, atau magnesium dan menghasilkan
gas hidrogen, sedangkan basa tidak bereaksi dengan logam aktif.
- Logam
aktif adalah logam yang mudah melepaskan elektronnya dan membentuk ion positif.
Gas hidrogen adalah gas tak berwarna dan tak berbau yang terbentuk dari atom
hidrogen.
- Asam
bereaksi dengan basa dan menghasilkan garam dan air, sedangkan basa bereaksi
dengan asam dan menghasilkan garam dan air.
Apa Contoh Asam dan Basa?
Asam dan
basa banyak ditemukan di alam maupun di laboratorium. Berikut adalah beberapa
contoh asam dan basa:
- Asam
klorida (HCl) adalah asam kuat yang digunakan dalam industri kimia dan sebagai
pembersih logam. Asam klorida terdapat dalam lambung manusia sebagai bagian
dari cairan pencernaan.
- Asam
sitrat (C6H8O7) adalah asam lemah yang
terdapat dalam buah-buahan seperti jeruk, lemon, atau grapefruit. Asam sitrat
digunakan sebagai pengawet makanan, bahan pembuat minuman, atau bahan kosmetik.
- Basa
natrium hidroksida (NaOH) adalah basa kuat yang digunakan dalam industri sabun,
kertas, atau tekstil. Basa natrium hidroksida juga dikenal sebagai soda api
atau kaustik soda.
- Basa
amonium hidroksida (NH4OH) adalah basa lemah yang terdapat dalam
amonia cair. Basa amonium hidroksida digunakan sebagai pembersih rumah tangga,
pupuk, atau bahan pewarna.
Gambar : Contoh asam dan basa
Bagaimana Cara Mengenali Asam dan Basa?
Asam dan
basa dapat dikenali dengan menggunakan beberapa metode, seperti menggunakan
indikator asam-basa, mengukur pH larutan, atau melakukan reaksi kimia. Berikut
adalah penjelasan singkat tentang masing-masing metode:
-
Menggunakan indikator asam-basa: Indikator asam-basa adalah zat yang dapat berubah
warna sesuai dengan tingkat keasaman atau kebasaan suatu larutan. Contoh
indikator asam-basa adalah kertas lakmus, fenolftalein, atau kunyit. Kertas
lakmus berwarna merah jika dicelupkan ke dalam larutan asam dan berwarna biru
jika dicelupkan ke dalam larutan basa. Fenolftalein berwarna tak berwarna jika
dicelupkan ke dalam larutan asam dan berwarna merah muda jika dicelupkan ke
dalam larutan basa. Kunyit berwarna kuning jika dicelupkan ke dalam larutan
asam dan berwarna merah jika dicelupkan ke dalam larutan basa.
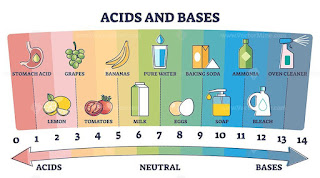
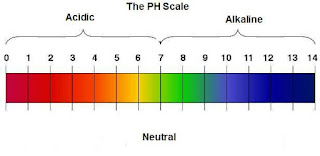
- Mengukur
pH larutan: pH adalah ukuran yang menunjukkan tingkat keasaman atau kebasaan
suatu larutan. pH berkisar dari 0 sampai 14. Larutan dengan pH kurang dari 7
disebut asam, larutan dengan pH lebih dari 7 disebut basa, dan larutan dengan
pH sama dengan 7 disebut netral. pH dapat diukur dengan menggunakan alat yang
disebut pH meter atau dengan menggunakan kertas indikator pH yang memiliki
skala warna yang sesuai dengan nilai pH.
Gambar :
Skala pH
- Melakukan
reaksi kimia: Reaksi kimia adalah proses perubahan zat menjadi zat lain dengan
melibatkan ikatan atom. Reaksi kimia dapat digunakan untuk mengenali asam dan
basa dengan melihat produk yang dihasilkan. Contoh reaksi kimia untuk mengenali
asam dan basa adalah sebagai berikut:
- Reaksi asam dengan logam aktif: Asam
bereaksi dengan logam aktif seperti seng, besi, atau magnesium dan menghasilkan
gas hidrogen. Gas hidrogen dapat dikenali dengan menggunakan korek api. Jika
gas hidrogen dinyalakan dengan korek api, maka akan terdengar suara letupan.
- Reaksi basa dengan minyak: Basa bereaksi dengan minyak dan menghasilkan sabun. Sabun dapat dikenali dengan melihat busanya. Jika larutan menghasilkan busa ketika dikocok, maka itu adalah sabun.
Kesimpulan
Asam basa
adalah dua kelompok zat kimia yang memiliki sifat berlawanan. Asam adalah zat
yang dapat memberikan ion hidrogen (H+) atau proton kepada zat lain.
Basa adalah zat yang dapat menerima ion hidrogen (H+) atau proton
dari zat lain.
Asam dan
basa memiliki beberapa sifat khas yang dapat digunakan untuk mengenali dan
membedakannya. Asam dan basa banyak ditemukan di alam maupun di laboratorium.
Asam dan basa dapat dikenali dengan menggunakan beberapa metode, seperti menggunakan indikator asam-basa, mengukur pH larutan, atau melakukan reaksi kimia.



Tidak ada komentar:
Posting Komentar