Contoh Soal Kesetimbangan Kimia
Kesetimbangan kimia adalah salah satu konsep penting dalam ilmu kimia. Namun, memahami kesetimbangan kimia tidaklah mudah. Oleh karena itu, kami telah menyediakan 10 contoh soal kesetimbangan kimia yang mudah dipahami. Dalam artikel ini, Anda akan belajar tentang konsep dasar kesetimbangan kimia dan melihat bagaimana konsep ini diterapkan dalam berbagai situasi. Semua contoh soal disertai dengan penjelasan yang jelas dan mudah dipahami. Dengan belajar dari contoh soal yang kami sediakan, Anda akan menjadi lebih percaya diri dalam menghadapi masalah kesetimbangan kimia.
Soal 1
Tuliskan ungkapan kesetimbangan untuk reaksi kesetimbangan kimia fase gas berikut:
Solusi:
Soal 2
Pemutih cucian rumah tangga adalah larutan hipoklorit natrium (NaOCl) yang dibuat dengan menambahkan gas Cl2 ke dalam larutan hidroksida natrium:
Agen pemutih aktif adalah ion hipoklorit, yang dapat terurai menjadi ion klorida dan klorat dalam reaksi sampingan yang bersaing dengan pemutihan:
Tuliskan
ungkapan keseimbangan untuk reaksi dekomposisi tersebut.
Solusi:
Soal 3
Asam
hipoklorit (HOCl) dihasilkan dengan memasukkan gas klorin melalui suspensi
oksida merkuri(II) yang digerakkan dalam air. Persamaan kimia untuk proses ini
adalah
Solusi:
HgO
dan HgO.HgCl2 tidak dimasukkan karena HgO dan HgO.HgCl2 adalah zat padat, dan air tidak dimasukkan
karena air adalah cairan murni. Klorin, sebagai gas, dimasukkan sebagai tekanan
parsial. HOCl dimasukkan sebagai konsentrasi dalam mol per liter. Baik
konsentrasi HOCl maupun tekanan parsial Cl2 dikuadratkan karena
koefisiennya masing-masing dalam persamaan kimia adalah 2.
Soal 4
ΔGo reaksi kimia
adalah
-104.180 J.mol-1 . Hitung tetapan kesetimbangan untuk reaksi tersebut
pada 25oC.
Solusi:
Soal 5
Hitung ΔGo dan tetapan ksetimbangan pada 25oC untuk reaksi
Diketahui
ΔGfo
ClO-(aq) = -36,8 kJ.mol-1, ΔGfo
Cl-(aq) = -131,23 kJ.mol-1, ΔGfo
ClO3-(aq) = -7,95 kJ.mol-1
Solusi:
ΔGo = 2 ΔGfo
Cl-(aq) + ΔGfo ClO3-(aq)
- 3 ΔGfo ClO-(aq)
ΔGo = (2 mol) (-131,23
kJ.mol-1) + (1 mol) (-7,95 kJ.mol-1) – (3mol) (-36,8
kJ.mol-1)
ΔGo = -160,01 kJ.mol-1
= -160.010 J.mol-1
Kemudian,
tetapan tetapan kesetimbangan dapat kita hitung menggunakan rumus:
ln K =
- ΔGo/(RT) = -(-160.010 J.mol-1)/(8,315
J.mol-1.K-1 x 298,15 K) = 64,54
K = e64,54
= 1,1 x 1028
Soal 6
Oksida nitrogen terdeteksi dalam laporan pencemaran udara. Pada suhu 25°C, konstanta kesetimbangan untuk reaksi tersebut adalah
dan
tentukan tetapan kesetimbangan K3 untuk reaksi
Solusi:
Pertama kita jumlahkan reaksi pertama dan kedua, akan menghasilkan:
dengan
nilai K merupakan hasil perkalian K1 dan K2:
K = K1.K2
= (1,3x106)(6,5x10-16) = 8,45x10-10
Kemudian
reaksi tersebut dikali 2 agar mendapatkan reaksi yang diinginkan, maka nilai K3
adalah kuadrat dari K:
K3
= K2 = (8,45x10-10)2 = 71,4025x10-20
= 7,14025x10-19
Soal 7
Gas fosgen terbentuk dari CO dan CL2 menurut reaksi kesetimbangan:
Pada
suhu 600°C, campuran gas CO dan Cl2 disiapkan dengan tekanan parsial
awal (sebelum reaksi) sebesar 0,60 atm untuk CO dan 1,10 atm untuk Cl2.
Setelah campuran reaksi mencapai kesetimbangan, tekanan parsial COCl2(g)
pada suhu ini diukur sebesar 0,10 atm. Hitunglah konstanta kesetimbangan untuk
reaksi ini. Reaksi dilakukan dalam wadah berukuran tetap.
Solusi:
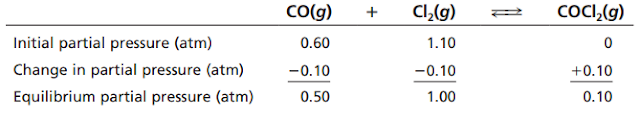
Untuk menemukan konstanta kesetimbangan, kita perlu menentukan tekanan parsial CO dan Cl2 pada kesetimbangan. Untuk melakukannya, kita membuat tabel sederhana:
Setiap mol COCl2 yang dihasilkan mengonsumsi tepat 1 mol CO dan 1 mol Cl2 (sesuai perbandingan koefisien). Menurut persamaan gas ideal, tekanan parsial gas berbanding lurus dengan jumlah mol setiap gas yang hadir selama volume dan suhu tetap. Oleh karena itu, perubahan tekanan parsial setiap gas harus berbanding lurus dengan perubahan jumlah molnya saat campuran menuju kesetimbangan. Jika tekanan parsial COCl2 meningkat sebesar 0,10 atm melalui reaksi, tekanan parsial CO dan Cl2 masing-masing harus berkurang sebesar 0,10 atm. Masukkan nilai-nilai ini ke dalam tabel:
Terakhir, kita hitung tetapan kesetimbangan menggunakan ungkapan tetapan kesetimbangan:
Soal 8
Grafit
(sejenis karbon padat) ditambahkan ke dalam sebuah wadah yang berisi CO2(g)
pada tekanan 0,824 atm pada suhu tinggi tertentu. Tekanan meningkat karena
terjadi reaksi yang menghasilkan CO(g). Tekanan total mencapai nilai kesetimbangan
sebesar 1,366 atm.
(a)
Tuliskan persamaan reaksi kesetimbangan untuk proses tersebut.
(b)
Hitunglah konstanta kesetimbangan.
Solusi:
(a) Reaksi hanya bisa menjadi oksidasi C oleh CO2 yang mana CO2 sendiri direduksi menjadi CO. Reaksi kesetimbangan ditulis sebagai
(b) Untuk menentukan tetapan kesetimbangan, kita harus mencari tekanan parsial CO dan CO2 pada saat kesetimbangan
Tekanan
total pada saat kesetimbangan adalah:
Ptot =
(0,824-x) + 2x = 0,824+x = 1,366 atm
Kemudian kita dapat menentukan nilai x:
0,824+x
= 1,366
x = 1,366
– 0,824 = 0,542 atm
Tekanan
parsial masing-masing gas yaitu:
PCO
= 2x = 2(0,542 atm) = 1,084 atm
PCO2
= 0,824 – x = 0,824 – 0,542 = 0,282 atm
Sehingga
tetapan kesetimbangan reaksi tersebut adalah
K =
(1,084)2/0,282 = 4,17
Soal 9
Anggap H2(g) dan I2(g) disimpan dalam sebuah labu pada T = 400 K dengan tekanan parsial PH2 = 1,320 atm dan PI2 = 1,140 atm. Pada suhu ini, H2 dan I2 tidak bereaksi dengan cepat untuk membentuk HI(g), meskipun setelah waktu yang cukup lama akan dihasilkan HI(g). Jika gas-gas tersebut dipanaskan dalam labu tertutup hingga mencapai suhu 600 K, suhu di mana mereka dengan cepat mencapai kesetimbangan:
Tetapan
kesetimbangan reaksi tersebut adalah 92,6 pada 600 K
a
Tentukan nilai PH2, PI2 dan PHI saat
kesetimbangan pada 600 K
b Berapa
persen I2 yang telah bereaksi ketika mencapai kesetimbangan?
Solusi:
a
Pertama kita tentukan terlebih dahulu tekanan parsial H2 dan I2
sebelum bereaksi. Kita dapat menggunakan hokum gas ideal ketika volume tetap:
PH2
= (1,320 atm) x (600 K/400 K) = 1,980 atm
PI2
= (1,140 atm) x (600 K/400 K) = 1,710 atm
Lalu kita tentukan tekanan pasrial masing-masing gas pada saat kesetimbangan
Masukkan tekanan parsial kesetimbangan ke dalam ungkapan tetapan kesetimbangan
Selesaikan
persamaannya dan dihasilkan:
88,6x2
– 341,694 + 313,525 = 0
X1 =
1,5044 atm dan X2 = 2,3522 atm
Nilai
X2 tidak mungkin karena akan menghasilkan jawaban negatif untuk tekanan parsial
H2(g) dan I2(g) pada saat setimbang. Maka nilai X1 = 1,5044 atm adalah nilai
yang memenuhi. Terakhir, masukkan nilai x untuk mencari tekanan parsial
masing-masing gas pada saat kesetimbangan:
PHI
= 2x = 2(1,5044 atm) = 3,0088 atm
PH2
= 1,980 atm – x = 1,980 atm – 1,5044 atm = 0,4756 atm
PI2
= 1,710 atm – x = 1,710 atm – 1,5044 atm = 0,2056 atm
b
persen I2 yang telah bereaksi adalah
%I2
yang bereaksi = (1,5044/1,710)x100% = 87,97%
Soal 10
Gas hidrogen dibuat dari gas alam (metana) untuk digunakan langsung dalam proses industri, seperti produksi amonia. Langkah pertama disebut "pengorekan uap metana":
Konstanta
kesetimbangan untuk reaksi ini adalah 1,8 × 10-27 pada 600 K. CH4
gas, H2O, dan CO dimasukkan ke dalam wadah yang dievakuasi pada suhu
600 K, dan tekanan parsial awal mereka (sebelum reaksi) masing-masing adalah
1,40 atm, 2,30 atm, dan 1,60 atm. Tentukan tekanan parsial H2(g)
yang akan terjadi pada kesetimbangan.
Solusi:
Tetapan kesetimbangan reaksinya yaitu:
Setelah itu kita tentukan tekanan parsial gas pada kesetimbangan:
Masukkan tekanan parsial gas masing-masing pada saat kesetimbangan ke dalam persamaan tetapan kesetimbangan:
Tetapan kesetimbangan dalam kasus ini cukup kecil, sehingga tingkat reaksi juga akan kecil. Ini menunjukkan bahwa y akan menjadi angka kecil relatif terhadap tekanan parsial gas yang hadir pada awalnya. Mari kita coba perkiraan bahwa y dapat diabaikan. Maka nilai 1,60 + y akan mendekati 1,60, 1,4 –y akan mendekati 1,4, dan 2,3 – y akan mendekati 2,3. Sehingga persamaannya dapat ditulis
Maka diperoleh
nilai y3 = 1,34x10-8, dan y = 2,38x10-3
Terakhir,
kita masukkan nilai y untuk mendapatkan tekanan H2:
PH2 = 3y = 3(2,38x10-3 atm) = 7,1x10-3 atm
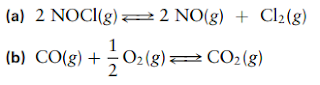

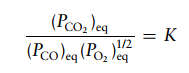
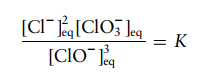
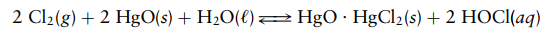
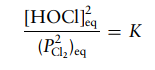
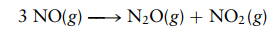
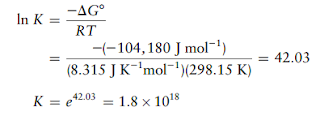

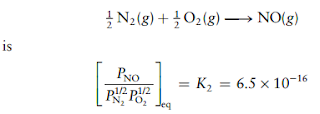
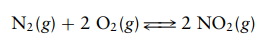
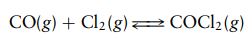


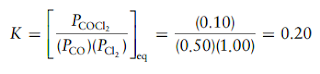


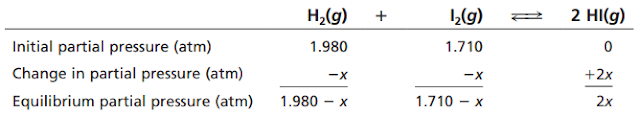
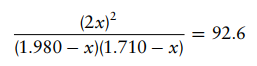





Tidak ada komentar:
Posting Komentar