Kimia organik adalah materi yang menjadi momok bagi semua orang yang mempelajari kimia. Baik siswa, mahasiswa, bahkan guru juga merasa dan berpikir hal yang sama tentang kimia organik bahwa kimia organik itu sulit. Mungkin anda yang sedang membaca artikel ini salah satu dari orang yang merasakan kesulitan mempelajari kimia organik. Reaksi-reaksi senyawa organik yang sangat banyak, dengan reagen (pereaksi) yang juga tak kalah banyak, dan kondisi reaksi yang berbeda-beda membuat sulitnya mempelajari kimia organik terutama reaksi-reaksinya.
Sulitnya mempelajari kimia organik bukan berarti bahwa kita tidak dapat mempelajarinya. Ada beberapa pemahaman dasar yang harus diketahui sebelum mempelajari kimia organik. Diperlukan pengetahuan tentang keelektronegatifan, kepolaran senyawa, pemutusan homolitik dan heterolitik, serta nukleofil dan elektrofil. Anda bisa membaca pendahuluan mekanisme reaksi senyawa organik.
Soal kimia organik adalah soal yang selalu muncul pada soal olimpiade kimia baik tingkat kabupaten, provinsi maupun tingkat nasional. Sehingga mengetahui tentang kimia organik bahkan menguasai materi kimia organik adalah hal yang wajib bagi setiap siswa yang ingin sukses di bidang olimpiade. Belakangan jumlah soal kimia organik yang muncul di olimpiade cukup banyak. Soal olimpiade pada soal tingkat kabupaten dan provinsi berkisar 10-12 nomor untuk soal tipe pilihan ganda dan sekitar 1-2 nomor untuk soal tipe esay.
Salah satu materi kimia organik yang sering muncul pada soal olimpiade adalah materi alkohol. Struktur, tata nama, sifat fisika dan kimia serta reaksi-reaksi alkohol sering muncul pada soal olimpiade baik tingkat kabupaten, provinsi maupun nasional. Berikut saya akan membahas tentang alkohol. Untuk pembahasan soal-soal tentang alkohol yang sering muncul di olimpiade saya akan bahas pada artikel berikutnya.
Struktur
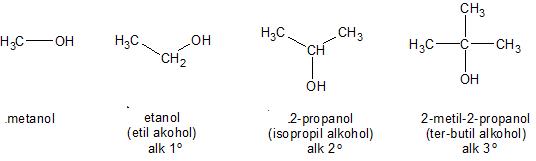
Alkohol merupakan senyawa yang mempunyai rumus umum ROH, dimana R merupakan alkil atau alkil yang tersubstitusi dan hidrokarbon siklis. Gugus fungsi hidroksil (OH) dapat terikat pada atom karbon jenuh. Alkohol disini tidak termasuk phenol (gugus hidroksil berikatan dengan cincin aromatik), enol (gugus hidroksil berikatan dengan karbon vinylik) sehingga mempunyai sifat-sifatnya kadang berbeda. Alkohol dapat dianggap merupakan turunan dari ari (H-O-H), dimana satu atom hidrogennya diganti dengan gugus alkil. Alkohol diklasifikasikan menjadi tiga kelompok yaitu, alkohol primer, sekunder, dan tersier. Gugus alkil dapat mempunyai ikatan rangkap, atom halogen atau cincin aromatis.
Sedangkan alkohol yang gugus hidroksilnya berikatan dengan karbon tak jenuh (sp2) dan hidrokarbon siklis adalah:
Sifat-sifat Fisik
Alkohol mempunyai gugus sangat polar -OH, gugus ini mengandung hidrogen yang berikatan dengan atom oksigen yang sangat elektronegatif oleh karenanya dapat mengadakan ikatan hidrogen. Alkohol mempunyai persamaan geometris dengan air, sudut ikatan R-O-H mendekati nilai tetrahedral dan atom oksigen terhibridisasi sp3. Alkohol dapat membentuk ikatan hidrogen intramolekuler sehingga alkohol mempunyai titik didih lebih besar daripada eter yang bersesuaian.
Faktor lain yang menentukan besar kecilnya titik didih suatu alkohol selain adanya ikatan hidrogen adalah berat molekul dan bentuk molekulnya (lurus atau bercabang). Dengan naiknya jumlah atom karbon pada alkohol, maka naik pula titik didihnya, dan akan menurun titik didih dengan adanya rantai cabang.
Sumber-sumber Industri dan Pembuatan Alkohol
Alkohol merupakan bahan baku yang paling penting dalam kimia hidrokarbon, dapat tersedia dalam jumlah yang melimpah dan berharga murah. Ada tiga metode untuk menghasilkan alkhol yang sederhana, yaitu:
- Hidrasi alkena yang diperoleh dari reaksi cracking petroleum.
- Proses oxo dari alkena, karbon monoksida dan hidrogen.
- fermentasi karbohidrat
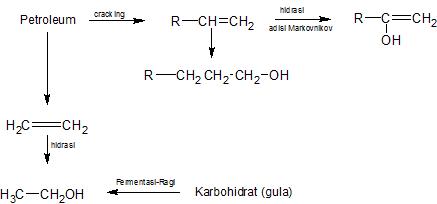 |
| Gambar: Metode Pembuatan Alkohol Secara Sederhana |
Sedangkan cara lain dalam pembuatan alkohol dapat menggunakan salah satu dari metode di bawah ini:
Oxymercurasi - Demercurasi
Alkena bereaksi dengan merkuri asetat dengan adanya air menjadi senyawa hidroksi merkuri yang jika direduksi akan menghasilkan alkohol.
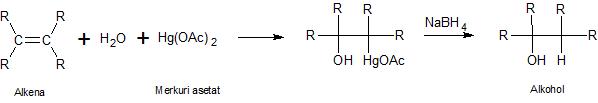 |
| Gambar: Reaksi Umum Oxymercurasi - Demercurasi |
Langkah pertama adalah oksimerkurasi, yaitu adisi ikatan rangkap dengan -OH dan HgOAc. Kemudian demerkurasi, yaitu penggantian -HgOAc dengan -H. Oksimerkurasi-demerkurasi merupakan reaksi regioselektif dan menghasilkan alkohol melalui adisi Markovnikov. Berikut contoh reaksi pembuatan 2-metil-2-butanol menggunakan metode oksimerkurasi-demerkurasi.
Hydroborasi - Oksidasi
 |
| Gambar: Reaksi Umum Hydroborasi - Oksidasi |
Sintesa Grignard
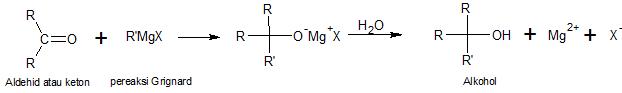 |
| Gambar: Reaksi Umum Pembuatan Alkohol dengan Metode Sintesa Grignard |
Alkohol yang diperoleh dari sintesa Grignard, tergantung dari jenis senyawa karbonil yang dipakai. Jika yang digunakan formaldehid (metanal) maka hasilnya adalah alkohol primer, jika asetaldehid (etanal) atau aldehid yang lain selain formaldehid maka hasilnya alkohol sekunder dan jika keton maka alkohol tersier yang terbentuk.
Reaksi-reaksi Alkohol
Reaksi pada alkohol merupakan reaksi substitusi yaitu menggantikan -OH atau -H dan juga dapat berlangsung reaksi eliminasi dengan membentuk ikatan rangkap dua.
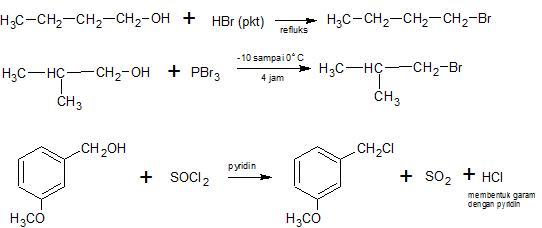
Reaksi dengan hidrogen halida (HX), Fosfor tribomida (PBr3) dan Thionyl klorida (SOCl2)
Alkohol bereaksi dengan hidrogen halida, fosfor tribromida (PBr3) dan Thionyl klorida (SOCl2) menghasilkan alkil halida. Urutan reaktifitas hidrogen halida HI > HBr > HCl, sedangkan reaktifitas alkohol adalah : allyl > benzil > 3o > 2o > 1o > metil. Umumnya reaksi berlangsung dalam suasana asam kuat.
Reaksi Dehidrasi
Salah satu reaksi yang paling penting dari alkohol adalah dehidrasi membentuk produk alkena. Ikatan C-O dan ikatan C-H yang bersebelahan akan putus dan membentuk ikatan Л.
 |
| Gambar: Reaksi Umum Dehidrasi Alkohol |
Reaksi dehidrasi memerlukan adanya asam dan pemanasan. Urutan reaktifitas alkohol : 3o > 2o > 1o .
Reaksi Alkohol dengan Logam
Keasaman alkohol dapat dilihat jika direaksikan dengan logam akan mengeluarkan gas hidrogen dan alkoksida.
RO-H + M ➙ RO-M + 1/2 H2
M = Na, K, Mg, Al, dst
Reaktifitas alkohol: CH3OH > 1o > 2o > 3o .
CH3CH2OH + Na ➙ CH3CH2O-Na+ + 1/2 H2
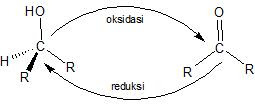
Reaksi Oksidasi
Salah satu reaksi dari alkohol yang sangat berharga adalah oksidasi membentuk senyawa karbonil, sedangkan reduksi karbonil akan menghasilkan alkohol.
Oksidasi alkohol mengakibatkan hilangnya satu atau lebih atom hidrogen alfa yang terikat pada atom karbon yang mempunyai gugus -OH. Alkohol primer mempunyai dua hirogen alfa, yang dapat kehilangan satu atau kedua atom hidrogen alfa menjadi aldehid atau asam karboksilat.
Alkohol primer dioksidasi menghasilkan aldehid atau asam karboksilat sangat tergantung pada pemilihan pereaksi dan kondisi reaksinya. Berikut beberapa pereaksi yang dapat dipakai untuk oksidasi alkohol :
- Pyridin kloro kromat (PCC) dalam pelarut diklorometana dapat mengoksidasi alkohol primer menjadi aldehid.
- Pereaksi Jones (CrO3 dalam asan sulfat), akan mengoksidasi alkohol primer menjadi asam karboksilat.
- Natrium dikromat (Na2Cr2O7) dalam larutan asam asetat dapat mengoksidasi alkohol sekunder menjadi keton.
Referensi:
Riswiyanto, 2012. Langkah Sukses Menuju Olimpiade Kimia Organik Tingkat SMA/MA. Bina Prestasi Insani. Jakarta

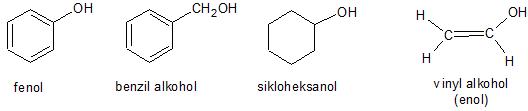

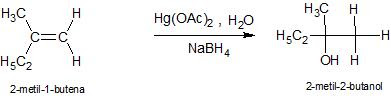


Tidak ada komentar:
Posting Komentar