Soal dan Pembahasan Berkaitan dengan Alkohol
Soal olimpiade tentang kimia organik tidak konsisten untuk suatu materi tertentu. Tiap tahun soal olimpiade tentang kimia organik selalu berubah-ubah. Tahun ini tentang reaksi substitusi alkohol, reaksi ozonolisis, ataupun tata nama alkena, tahun depan tentang reaksi kondensasi aldol, reaksi substitusi elektrofilik benzena, ataupun stereoisomer, tahun depannya lagi tentang tata nama amina, kereaktifan turunan asam karboksilat dan masih banyak lagi. Hal ini adalah sesuatu yang wajar, mengingat materi kimia organik yang sangat luas dengan reaksi-reaksi yang banyak dan kondisi reaksi yang berbeda-beda.
Dalam kimia organik sangat dibutuhkan daya ingat yang kuat untuk mengingat pereaksi-pereaksi yang digunakan beserta produk yang dihasilkan. Jika anda memiliki daya yang kuat maka anda sudah punya satu alat yang berguna untuk menguasai materi kimia organik. Selain itu, anda juga perlu membuat rangkuman catatan untuk setiap reaksi-reaksi yang terjadi. Dengan begitu, anda akan mudah membukanya kembali jika suatu saat anda lupa reaksinya.
Pada artikel kali ini, saya akan membagikan soal-soal dan pembahasannya yang berkaitan dengan alkohol. Sebelumnya pada artikel Mengupas Tuntas Soal Olimpiade Kimia Organik Materi Alkohol (Part I) telah dibahas tentang alkohol, baik struktur dan tata nama, sifat fisik, pembuatan hingga reaksi-reaksi alkohol. Pada artikel Mengupas Tuntas Soal Olimpiade Kimia Organik Materi Alkohol (Part II) saya akan membahas tentang soal-soal yang berkaitan dengan alkohol. Soal-soal yang akan saya bahas kali ini saya ambil dari buku "Langkah Sukses Menuju Olimpiade Kimia Organik Tingkat SMA/MA" karangan Riswiyanto. Saya belum mengambil secara langsung soal-soal tentang alkohol yang telah muncul di olimpiade sains tingkat kabupaten, provinsi maupun nasional. Untuk soal-soal tentang alkohol yang telah muncul pada olimpiade saya akan bahas pada artikel berikutnya Mengupas Tuntas Soal Olimpiade Kimia Organik Materi Alkohol (Part III).
Soal dan Jawaban
1. Tuliskan struktur molekul dan berikan nama IUPAC dari semua isomer alkohol dengan rumus molekul C4H10O
Jawab:
2. Bagaimana saudara dapat membuat senyawa berikut dari 2-feniletanol
a. Styrena
b. Fenil asetaldehid
c. Asam fenilasetat
d. Asam benzoat
e. Etil benzena
Jawab:
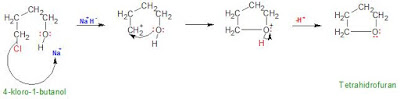
3. Jika 4-kloro-1-butanol direaksikan dengan basa kuat seperti natrium hidrida, NaH akan dihasilkan tetrahidrofuran. Ramalkan mekanisme reaksinya.
Jawab:
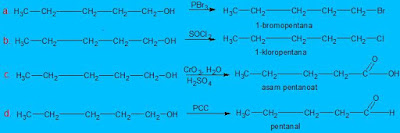
4. Produk apa yang akan saudara dapatkan jika 1-pentanol direaksikan dengan pereaksi-pereaksi berikut di bawah ini:
a. PBr3
b. SOCl2
c. CrO3, H2O, H2SO4
d. PCC (Piridin Chloro Chromat)
Jawab:
5. 2,2-dimetilsikloheksanol didehidrasi dengan adanya katalis asam, hasilnya merupakan campuran 1,2-dimetilsikloheksana dan isopropiledensiklopentana. Bagaimana mekanisme terbentuknya kedua senyawa tersebut:
Jawab:
Jawab:
2. Bagaimana saudara dapat membuat senyawa berikut dari 2-feniletanol
a. Styrena
b. Fenil asetaldehid
c. Asam fenilasetat
d. Asam benzoat
e. Etil benzena
Jawab:
3. Jika 4-kloro-1-butanol direaksikan dengan basa kuat seperti natrium hidrida, NaH akan dihasilkan tetrahidrofuran. Ramalkan mekanisme reaksinya.
Jawab:
4. Produk apa yang akan saudara dapatkan jika 1-pentanol direaksikan dengan pereaksi-pereaksi berikut di bawah ini:
a. PBr3
b. SOCl2
c. CrO3, H2O, H2SO4
d. PCC (Piridin Chloro Chromat)
Jawab:
5. 2,2-dimetilsikloheksanol didehidrasi dengan adanya katalis asam, hasilnya merupakan campuran 1,2-dimetilsikloheksana dan isopropiledensiklopentana. Bagaimana mekanisme terbentuknya kedua senyawa tersebut:
 |
| Isopropiledensiklopentana |










Tidak ada komentar:
Posting Komentar