Sifat koligatif larutan adalah sifat-sifat yang bergantung pada jumlah partikel dalam larutan, bukan identitas partikel tersebut. Ada beberapa contoh soal yang dapat membantu kita memahami sifat koligatif larutan dengan lebih baik. Berikut ini adalah 6 contoh soal sifat koligatif larutan yang dapat membantu meningkatkan pemahaman kita tentang sifat koligatif larutan.
Soal 1
Pada
suhu 25°C, tekanan uap benzena murni adalah P1o = 0,1252
atm. Jika 6,40 g naftalena, C10H8 (massa molar
128,17 g.mol-1), dilarutkan dalam 78,0 g benzena (massa molar 78,0
g.mol-1). Hitung tekanan uap larutan tersebut,
dengan mengasumsikan perilaku larutan ideal.
Solusi:
Jumlah mol pelarut, n1, dalam kasus ini adalah 1,00 mol (karena digunakan 78,0 g = 1,00 mol benzena ). Jumlah mol zat terlarut adalah n2 = 6,40 g/128,17 g mol-1 = 0,0499 mol C10H8; maka, fraksi mol X1 adalah
Soal 2
(a)
Ketika 5,50 g biphenyl (C12H10) dilarutkan dalam 100,0 g
benzene, titik didihnya meningkat sebesar 0,903°C. Hitung Kb untuk benzene.
(b)
Ketika 6,30 g hidrokarbon yang tidak diketahui dilarutkan dalam 150,0 g
benzene, titik didih larutan meningkat sebesar 0,597°C. Berapakah massa molar
zat yang tidak diketahui tersebut?
Solusi:
(a) Karena massa molar biphenyl adalah 154,2 g mol-1, maka 5,50 g biphenyl mengandung 5,50 g/154,2 g mol-1 = 0,0357 mol. Molalitas, m, adalah
(b) Berdasarkan hukum Raoult, kenaikan titik didih tergantung pada molalitas larutan. Dalam hal ini, kenaikan titik didih adalah 0,597°C. Jadi, molalitas larutan dapat dihitung dengan rumus
Jumlah mol zat terlarut adalah hasil dari perkalian molalitas larutan dengan massa pelarut, m1:
Terakhir, massa molar zat terlarut adalah hasil dari pembagian massa zat terlarut dengan jumlah molnya:
Hidrokarbon
yang tidak diketahui mungkin adalah antracene (C14H10),
yang memiliki massa molar 178,24 g.mol-1.
Soal 3
Klorida lantanum (III) (LaCl3) adalah garam yang sepenuhnya terdisosiasi menjadi ion dalam larutan air encer,
menghasilkan
4 mol ion per mol LaCl3. Anggap 0,2453 g LaCl3 dilarutkan
dalam 10,00 g H2O. Berapakah titik didih larutan pada tekanan
atmosfer, dengan mengasumsikan perilaku larutan ideal?
Solusi:
Massa
molar LaCl3 adalah 245,3 g.mol-1
Ini dimasukkan ke dalam persamaan untuk kenaikan titik didih:
Titik
didih sebenarnya sedikit lebih rendah dari nilai tersebut karena larutan
bersifat non-ideal.
Soal 4
Ketika
0,494 g K3Fe(CN)6 dilarutkan dalam 100,0 g air, titik
beku larutan ditemukan menjadi 20,093°C. Berapa banyak ion yang hadir untuk
setiap unit formula K3Fe(CN)6 yang dilarutkan?
Solusi:
Molalitas total dari semua spesies dalam larutan adalahKarena massa molar K3Fe(CN)6 adalah 329,25 g.mol-1, molalitas total jika tidak ada disosiasi terjadi akan menjadi
Ini berada di antara seperempat dan sepertiga dari molalitas total yang diukur dalam larutan, sehingga setiap K3Fe(CN)6 harus terdisosiasi menjadi tiga hingga empat ion. Sebenarnya, disosiasi yang terjadi adalah
Deviasi dari perilaku larutan yang ideal telah mengurangi molalitas total efektif dari 0,060 menjadi 0,050 mol kg-1.
Soal 5
Seorang
ahli kimia melarutkan 2,00 g protein dalam 0,100 L air. Tekanan osmosisnya
adalah 0,021 atm pada 25°C. Berapakah massa molar protein tersebut secara
aproximasi?
Solusi:
Konsentrasi dalam mol per liter adalah
Sekarang 2,00 g yang dilarutkan dalam 0,100 L memberikan konsentrasi yang sama dengan 20,0 g dalam 1,00 L. Oleh karena itu, 8,6 × 10-4 mol protein harus memiliki berat 20,0 g, dan massa molar adalah
Soal 6
Konstanta
hukum Henry untuk oksigen yang terlarut di dalam air adalah 4,34 × 104
atm pada suhu 25°C. Jika tekanan parsial oksigen di udara adalah 0,20 atm dalam
kondisi atmosfer biasa, hitunglah konsentrasi (dalam mol per liter) oksigen
yang terlarut dalam air yang berada dalam kesetimbangan dengan udara pada suhu
25°C.
Solusi:
Hukum Henry digunakan untuk menghitung fraksi mol oksigen dalam air.
Selanjutnya, fraksi mol diubah menjadi molaritas. Satu liter air memiliki berat 1000 g, sehingga mengandung
Karena XO2 sangat kecil, nH2O + nO2 mendekati nH2O, dan dapat ditulis sebagai
Dengan demikian, jumlah mol oksigen dalam 1 L air adalah


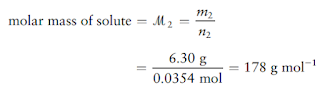
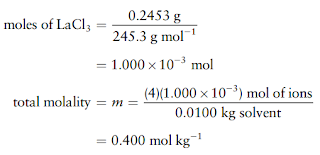
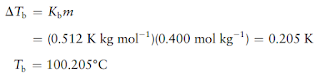
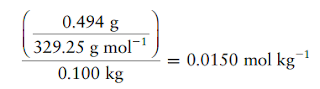

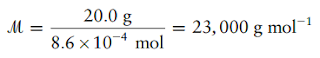
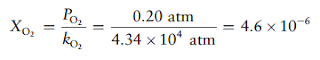
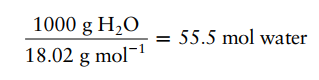
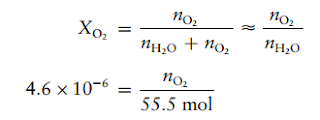


Tidak ada komentar:
Posting Komentar