Bila pada kesetimbangan kimia yang sedang berlangsung
diganggu, akan terjadi pergeseran ke kiri dan ke kanan sampai tercapai
kesetimbangan baru.
Hubungan antara reaksi yang timbul pada sistem
dengan aksi yang dilakukan, dirumuskan oleh Le Chatelier sebagai berikut.
1.
Perubahan Konsentrasi
Bila dalam kesetimbangan kimia yang sedang
berlangsung konsentrasi salah satu zat ditambah, kesetimbangan bergeser dari
zat yang ditambah.
Contoh pada kesetimbangan:
Setimbang 1 0,8 0,6 1,5 0,5
Penambahan +1
Pergeseran -x -2x +3x +x
Setimbang 2 (1,8-x) (0,6-2x) (1,5+3x) (0,5+x)
Aksi menambah A, reaksi mengurangi A dan
B/menambah C dan D
Bila ingin menghitung harga X.
Hitung harga tetapan kesetimbangan mula-mula
dan harga tetapan kesetimbangan kedua. Buat persamaan K1 = K2,
akan diperoleh harga X, pilih x positif yang kurang dari 0,3. Mengapa?
Contoh soal
Dalam ruang 6 L pada P dan T tertentu
terdapat dalam keadaan setimbang 0,8 mol gas H2, 0,5 mol gas Cl2
dan 0,6 mol gas HCl. Ke dalam ruang dimasukkan 0,2 mol gas H2 pada
suhu yang sama. Tentukan susunan kesetimbangan yang baru.
Penyelesaian:
Setimbang
(1) 0,8 0,5 0,6
Penambahan +0,2
Pergeseran -x -x +2x
Setimbang
(2) (1-x) (0,5-x) (0,6+2x)
Harga
K mula-mula:
Harga K sekarang:
Karena suhu tetap, harga K tetap
Kmula-mula = Ksekarang
x1 =0,023 dan x2 =
-1,23 (TM)
Jadi susunan kesetimbangan baru:
H2 = (1-0,023) mol = 0,97 mol
Cl2 = (0,5-0,023) mol = 0,47
mol
HCl = (0,6+0,046) mol = 0,646 mol
2.
Perubahan
volume
Jika dalam kesetimbangan kimia yang sedang
berlangsung volume ruang dipebesar, maka kesetimbangan akan bergeser ke pihak
reaksi yang jumlah koefisiennya besar.
Contoh
Pada kesetimbangan
Setimbang
1 (vol 5 L) 4 9 5 8
Vol
jadi 8 L
Pergeseran -x -2x +3x +4x
Setimbang 2 (vol 8L) (4-x) (9-2x) (5+3x) (8+4x)
Aksi memperbesar ruang
Reaksi: memperkecil ruang dengan cara
memperbanyak partikel zat
Mencari harga x: hitung harga K mula-mula dan
K baru, buat persamaan
Kmula-mula = Ksekarang,
pilih harga x yang kurang dari 4, mengapa?
Contoh Soal
Dalam ruang 5 L pada suhu tertentu terdapat
dalam keadaan setimbang 0,6 mol gas NH3, 0,8 mol gas HCl dan 1,2 mol
uap NH4Cl. Jika pada suhu tetap volume ruang dibesarkan menjadi 15
L. Tentukan susunan gas-gas pada keadaan setimbang yang baru.
Penyelesaian:
Reaksi kesetimbangan:
Setimbang
1 (V=5L) 0,6 0,8 1,2
Volume
diperbesar jadi 15 L
Pergeseran +x +x -x
Setimbang 2 (V=15L) (0,6+x) (0,8+x) (1,2-x)
Harga
K mula-mula:
Harga K sekarang:
Karena suhu tetap, harga K tetap
Kmula-mula = Ksekarang
x1 =0,32 dan x2 =
-2,9 (TM,negatif)
Jadi susunan kesetimbangan baru:
NH3 = (0,6+0,32) mol = 0,92
mol
HCl = (0,8+0,32) mol = 1,12 mol
NH4Cl = (1,2-0,32) mol = 0,88
mol
Catatan:
Faktor perubahan volume tidak berpengaruh
pada kesetimbangan dengan jumlah koefisien kiri dan kanan sama besar.
Contoh: H2(g) + I2(g)
2HI(g)
(koefisien kiri = koefisien kanan = 2)
Perubahan
volume dan tekanan berkebalikan, bila volume diperbesar identik dengan tekanan
diperkecil.
Jadi
pada kesetimbangan yang sedang berlangsung, jika tekanan ruang diperbesar,
kesetimbangan akan bergeser ke pihak reaksi yang jumlah koefisiennya lebih
kecil,dan sebaliknya.











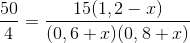



Tidak ada komentar:
Posting Komentar