Pendahuluan
Proses pemutusan ikatan kovalen dan pembentukan ikatan kovalen yang baru membutuhkan waktu yang sangat lama tergantung pada kondisi saat berlangsungnya suatu reaksi. Perbedaan keelektronegatifan antara atom-atom pada ikatan kovalen yang relatif kecil membuat ikatannya cukup kuat sehingga membutuhkan energi yang cukup besar untuk memutuskannya. Suhu dan tekanan yang cukup tinggi mungkin akan diperlukan dalam proses ini. Proses (pemutusan ikatan dan pembentukan ikatan baru) ini mungkin saja terjadi secara terpisah, seperti pada reaksi yang berlangsung secara bertahap (stepwise reaction)atau dapat berlangsung serentak (concerted reaction).
Pada reaksi yang berlangsung dalam beberapa tahap (langkah) untuk menghasilkan suatu senyawa, dikenal istilah intermediet atau zat antara yang terjadi sebelum produk dihasilkan. Intermediet merupakan suatu zat yang diduga mungkin terbentuk selama proses reaksi berlangsung. Intermediet ada yang dapat diisolasi dan ada juga yang tidak dapat diisolasi. Sedangkan pada reaksi yang berlangsung concerted atau serentak biasanya membentuk suatu kompleks teraktifkan atau keadaan transmisi yang tidak dapat diisolasi.
Studi yang mempelajari terjadinya pemutusan dan pembentukan ikatan, waktu reaksi, urutan reaksi, pergerakan elektron, dan kecepatan relatif setiap tahapan disebut mekanisme reaksi.
Pemutusan Homolitik dan Heterolitik
Suatu senyawa kovalen yang terdiri dari unsur A dan B dapat ditulis sebagai A-B atau A:B. Ikatan kovalen yang terbentuk antara A dan B dapat mengalami pemutusan dengan 2 cara. Pertama adalah pemutusan dengan cara homolisis yaitu pemutusan yang terjadi karena unsur A dan B memiliki perbedaan keelektronegatifan yang relatif kecil (senyawa nonpolar). Ketika mengalami pemutusan, A dan B masing-masing membawa elektron ikatan. Pemutusan ini menghasilkan unsur yang bersifat radikal (unsur yang memiliki satu elektron yang tak berpasangan / bebas). Pemutusan homolitik dapat digambarkan sebagai berikut :
Pemutusan yang kedua adalah pemutusan yang terjadi pada senyawa polar dimana unsur-unsur yang berikatan memiliki perbedaan kelektronegatifan yang relatif besar. Ketika senyawa polar AB mengalami pemutusan ikatan, maka unsur yang memiliki keelektronegatifan paling besar akan membawa elektron ikatan. Pemutusan dengan cara ini mengasilkan ion. Reaksi pemutusan heterolitik sebagai berikut :
Elektorifilik dan Nukleofilik
Bagian yang sangat penting dari mekanisme reaksi dan wajib kita ketahui adalah reagen elektrofil dan nukleofil. Reagen elektrofil (reagen yang menyukai elektron) adalah reagen yang kekurangan elektron sehingga cenderung untuk mencari elektron. Reagen elektrofil umumnya bermuatan positif namun ada juga elektrofil yang bermuatan netral. Berikut beberapa elektrofil positif dan elektrofil netral :
| Elektrofil positif | Elektrofil netral |
| proton H+ | aluminium tetraklorida |
| ion kloronium | boron trifluorida |
| ion bromonium | zink klorida |
| ion nitronium | sulfur trioksida |
| ion nitrosonium | klorida asam |
| ion karbonium | karbena |
Reagen nukleofilik (nukleofil) adalah reagen yang mempunyai pasangan elektron bebas. Reagen nukleofil mempunyai kecenderungan bereaksi dengan substrat yang kekurangan elektron. Nukleofil ada dua macam yaitu nukleofil negatif dan nukleofil netral. Nukleofil negatif yaitu nukleofil yang membawa pasangan elektron dan muatan negatif. Jika muatan negatif berada pada atom karbon disebut karbanion. Sedangkan nukleofil netral yaitu nukleofil yang kaya akan elektron namun tidak bermuatan. Contoh H2O dan NH3.
Ion Karbonim
Suatu senyawa karbon yang mengikat atom yang lebih elektronegatif, jika diputuskan melalui mekanisme heterolisis akan menghasilkan atom yang bermuatan negatif dan menarik elektron ikaan, sedangkan atom karbon akan kehilangan elektronnya. Pada keadaan ini karbon akan mempunyai muatan positif dan disebut ion karbonium.
Urutan kestabilan ion karbonium dapat terlihat dalam urutan kestabilan ion karbonium di bawah ini.
Ion Karbena
Ion karbena (R2C:) adalah suatu molekul nertal yang mempunyai atom karbon bervalensi dua sehingga hanya mempunyai enam elektron pada kulit terluarnya. Karbena sangat reaktif sehingga hanya merupakan suatu intermediet dan sulit untuk diisolasi. Karena hanya memiliki enam elektron pada kulit terluar, maka karbena kekurangan elektron atau bersifat elektrofilik (menyukai elektron). Ini menyebabkan karbena sangat mudah bereaksi dengan nukleofil (ikatan rangkap). Pada keadaan ini, reaksi berlangsung dalam satu langkah tanpa intermediet.Urutan kereaktifan karbena sebagai berikut.

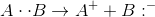








Tidak ada komentar:
Posting Komentar